Artículo
ARACNET, 6 - Bol. S.E.A., nº 27 (2000): 121-125
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Biología reproductora de algunos grupos de insectos acuáticos
José Manuel TIERNO DE FIGUEROA
Departamento de Biología Animal y Ecología.
Facultad de Ciencias. Universidad de Granada.
18071. Granada. España.
Introducción: Los insectos acuáticos y la reproducción
Los insectos forman un grupo enormemente conocido, tanto por el elevado numero de especies que lo componen (se trata del grupo animal con mayor riqueza específica) como por el hecho de interactuar continuamente con el ser humano causando perjuicios y beneficios directa o indirectamente. Sin duda, los insectos más conocidos para el público general tienen vida terrestre (sirvan como ejemplo los lepidópteros, los ortópteros o los himenópteros), sin embargo existen una serie de ordenes cuyos representantes, o parte de ellos, desarrollan toda o parte de su vida en el medio acuático, bien sean charcas, arroyos o lagos.
Básicamente podemos distinguir dos grandes grupos de insectos acuáticos, los que viven en el agua prácticamente toda su vida (algunas familias de coleópteros y de heterópteros; aunque también en estos grupos se presentan casos de organismos con formas juveniles acuáticas y adultos terrestres o a la inversa) y los que pasan una etapa de su vida (generalmente la fase juvenil de larva o ninfa) en el agua y otra (generalmente de adulto o etapa reproductora) en el medio terrestre, pero más o menos asociado a masas de agua, puesto que han de depositar sus huevos en dicho medio o en las proximidades. Es el caso general en grupos como odonatos, efemerópteros, plecópteros, megalópteros, tricópteros y muchos dípteros; además de algunos neurópteros como los osmílidos y sisíridos, himenópteros como los del género Agryotipus, larva parásita de insectos acuáticos, y algunos lepidópteros de la familia pirálidos. Es en este último conjunto de insectos en el que nos centraremos en el presente artículo. Para terminar la enumeración de insectos relacionados con la vida en agua dulce, habría que mencionar a los nannocorístidos, una familia de mecópteros exclusivos del hemisferio sur, y algunos grupos de insectos con especies asociadas a los medios acuáticos como los colémbolos (por ejemplo Podura aquatica).
La biología reproductora de los insectos acuáticos puede parecer al público general un tema muy concreto y limitado, pero las investigaciones que se están realizando al respecto muestran una diversidad de comportamientos enormemente atractivos, así como la aparición de las más sofisticadas estrategias reproductivas tanto en localización de la pareja, como en acoplamiento, guarda de la pareja, oviposición, etc. Todo esto hace que constituyan un tema de gran interés no sólo para los que los realizamos nuestras investigaciones en este campo, sino para todo aquel que desea entender la naturaleza en un sentido más amplio.
Fenología de la reproducción. Factores que influyen
Para la mayor parte de los grupos de insectos acuáticos, la etapa de vida adulta, reproductora o período de vuelo se concentra en un breve espacio de tiempo. El período de vuelo es la etapa de máximo potencial de dispersión para insectos con larvas o ninfas acuáticas (Hutchinson, 1981) y concentra todos los procesos reproductores que perpetúan la especie (Brittain, 1990).
La fenología de los períodos de vuelo o reproductora está muy condicionada en los insectos acuáticos por factores como la temperatura del agua o el fotoperiodo (Corbet, 1964; Sweeney, 1984) que actúan como estímulos desencadenando la respuesta fisiológica, en este caso la maduración y emergencia, de los individuos. Otros factores como las precipitaciones afectan también al momento de la emergencia, aunque esto es más notorio en zonas tropicales (Corbet, 1964). Asimismo se ha señalado el papel de otras condiciones como la humedad relativa, el viento, la temperatura del aire, etc. en determinadas circunstancias (Brinck, 1949; Nebeker, 1971; Saeten y Brittain, 1985). Por otra parte, tanto la temperatura como la cantidad y calidad del alimento, competencia inter- e intraespecífica afectan al individuo permitiéndole desarrollarse óptimamente o no y provocan también diferencias en el momento de la emergencia y en aspectos como la fecundidad de los individuos (Sweeney, 1984; Peckarsky y Cowan, 1991). La temperatura afecta también a la tasa de desarrollo larval o ninfal al influir en el metabolismo y asimilación del alimento (Sweeney, 1984).
En relación a estos factores, la altitud (debido sobre todo a las menores temperaturas) va a condicionar indirectamente la emergencia y en consecuencia el período de reproducción de muchas especies de insectos acuáticos, reproduciéndose en altitud los fenómenos que tienen lugar en latitud (fundamentalmente retrasos de la emergencia conforme ascendemos en altitud o latitud y las temperaturas son más bajas) (Sweeney, 1984).
Sirva como ejemplo lo que ocurre en Sierra Nevada en una especie de plecóptero (Leuctra andalusiaca Aubert, 1962) entre dos estaciones situadas a diferente altitud: un claro retraso, que es debido a que en aguas más frías las ninfas necesitan más tiempo para desarrollarse, lo que provoca en algunas ocasiones la aparición de ciclos de desarrollo más largos (Tierno de Figueroa et al., ms).
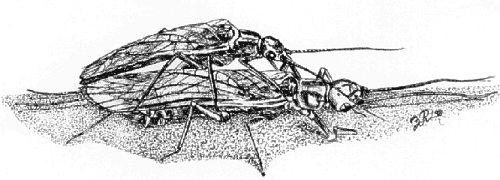
|
Fig. 1. Plecópteros en cópula (dibujo: Juan Ramón Fernández Cardenete). |
De todos modos, los factores ambientales relacionados con la altitud pueden influir de diferente modo a distintas especies, de manera que estudios realizados al respecto muestran que a veces aparecen fenómenos inversos, caso de Leuctra fusca (Linneo, 1758) en la que parece existir un adelanto con la altitud y temperaturas más frías (Tierno de Figueroa et al., ms). En otros casos Chloroperla nevada Zwick, 1967, L. inermis Kempny, 1899 o Leuctra maroccana Aubert, 1956, el período de vuelo observado es muy similar en las distintas altitudes, a pesar de las diferencias en temperaturas, por lo que parece que en estas especies el factor más importante en la regulación de la emergencia es el fotoperiodo con cierta independencia de la temperatura del agua (Tierno de Figueroa et al., ms).
Las características propias de alta montaña hacen también que el período de vuelo de algunas especies se prolongue durante la primavera y/o verano, mientras que en zonas más bajas con estiajes más acusados, impiden que la emergencias tengan lugar en dichas épocas. Estudios realizados al respecto, en el grupo de los plecópteros mostraron que dentro del sistema Penibético, el número de especies con período de vuelo estival, o que abarque parte del verano, es superior en Sierra Nevada que en sierras de menor altitud como la de Huétor (Luzón-Ortega et al., 1998) y la Serranía de Ronda (Tierno de Figueroa et al., 1996).
Estrategias reproductivas
Como apuntaron Wiley y Kholer (1984), los insectos acuáticos se encuentran con dos problemas que han de solventar durante su etapa adulta o reproductora:
1. Deben localizar físicamente potenciales parejas con las que copular.
2. Una vez localizadas deben competir individualmente con otros individuos para conseguir la cópula y consiguiente fertilización. Además en muchos casos han de asegurarse luego que su esperma no sea reemplazado por el de otro individuo, lo cual llevaría a una disminución, a veces drástica o extrema, de su éxito reproductor o eficacia biológica.
1. Búsqueda del apareamiento:
Siguiendo a estos mismos autores (Wiley y Kholer, 1984), destacamos tres tipos principales de mecanismos o sistemas de apareamiento que permiten o facilitan el encuentro entre ambos sexos.
a El más típico sistema de apareamiento en los insectos acuáticos es la formación de enjambramientos aéreos o swarm. Se forman auténticas nubes de individuos, generalmente machos, en vuelo. Las hembras llegan a estos enjambres, copulan y los abandonan para ovipositar. Existen también enjambres de hembras que entran en contacto con los de machos o incluso existen swarm mixtos (ej. en el mosquito Aedes). La formación de enjambres se da en efemerópteros, dípteros, tricópteros y ocasionalmente en odonatos. En los enjambres los machos suelen distinguir a las hembras de otros machos por reconocimiento visual o, como se ha visto en algunos mosquitos, por el tono producido por el vuelo. Ha sido señalada la importancia de los enjambres tanto para la localización de la pareja como para aislar poblaciones de diferentes especies, evitando gasto de tiempo, energía y gametos derivado de las cópulas interespecíficas.
b. Territorios de apareamiento. Aparece en odonatos y dípteros. Un macho defiende un área como lugar de oviposición que puede resultar atractivo para las hembras que llegan, copulan con él y ovipositan allí. El macho defiende su territorio con agresiones verdaderas, o físicas, y ritualizadas de otros machos que intenten usurpárselo. Las agresiones ritualizadas son más comunes, pues se ahorran infligirse daño, y consisten en vuelos que ponen de manifiesto la fuerza y agilidad de los contendientes.
c. Empleo de señales intersexuales que ayudan al encuentro de la pareja y sirven también como mecanismos de reconocimiento específico de especies que eviten apareamientos erróneos. El mecanismo más empleado es el uso de llamadas vibracionales mediante tamborileo (drumming), tremulación (vibración del abdomen o del cuerpo del animal que es transmitida por las patas al sustrato) o arrastre del abdomen sobre el sustrato. Este tipo de llamadas ha sido muy estudiadas en plecópteros (Stewart, 1997), pero también son empleadas por megalópteros y algunos tricópteros (Rupprecht, 1975; Ivanov y Rupprecht, 1992). Los machos producen llamadas y las hembras suelen responder. La hembra suele mantenerse estacionaria y es el macho el que se aproxima a ella. Se ha demostrado que estas llamadas pueden transmitirse a través del sustrato hasta una distancia de 8 metros en madera y ser detectadas por otro individuo (Stewart y Zeigler, 1984). Incluso se ha demostrado en una especie de plecóptero que la hembra puede decidir sobre la calidad del macho en función del tiempo que este tarda en localizarla desde que se establece un dúo y en caso de no interesarle abandonar su posición de espera (Abbott y Stewart, 1993). También se ha observado el empleo de estridulación u otro tipo de comunicación vibracional en coríxidos y gérridos (heterópteros) y sisíridos (neurópteros acuáticos) (Stewart, 1997). Otras señales empleadas para el encuentro y reconocimiento de la pareja son las visuales y el empleo de feromonas, muy generalizadas en los insectos.
2. Competición intrasexual.
En general los huevos de los insectos acuáticos son fertilizados en el momento de la oviposición, con el esperma almacenado en la espermateca o bolsa copulatriz de la hembra. Esto hace que el macho deba asegurarse la paternidad de la descendencia tras haber copulado con la hembra y desencadena comportamientos de guarda de la pareja que evitan que un nuevo macho desplace el esperma del que previamente ha copulado. Existen mecanismos tan elaborados como edeagos en forma de cucharilla que limpian la espermateca de la hembra antes de transmitir el esperma o tapones para evitar que la hembra copule con otro macho (Alcock y Gwynne, 1991). Esto ha sido muy estudiado en odonatos, en los cuales aparece el característico vuelo en tándem en el que el macho sujeta a la hembra para evitar que otro macho copule con ella y mantiene esta conducta hasta que la hembra ha ovipositado (contact guarding o guarda de contacto), en otros casos simplemente el macho sigue a la hembra para evitar que copule con otro macho (llamado noncontact guarding o guarda sin contacto) (Wiley y Kholer, 1984). El empleo de una u otra estrategia de guarda vendrá condicionado por el balance de costos y beneficios (una guarda de contacto es más efectiva pero el macho pierde oportunidades de nuevas cópulas y de defensa del territorio). En el caso de los plecópteros son frecuentes los intentos de desplazamiento durante la cópula por parte de otros machos, pero como hemos comprobado en estudios al respecto, el índice de logro en desplazamiento es muy bajo mientras el macho se mantiene en posición de cópula (Tierno de Figueroa, 1998; Tierno de Figueroa et al., 2000). Esto parece condicionar la existencia de cópulas de larga duración en especies con frecuentes intentos de desplazamiento (ej. Leuctra andalusiaca Aubert, 1962) y cortas en el caso contrario (ej. Capnioneura mitis Despax, 1932). En un caso concreto, en Leuctra fusca (Linneo, 1758), hemos comprobado estadísticamente que la duración de la cópula está influida por la existencia de intentos de desplazamiento por parte de otros machos, de forma el tiempo puede variar desde menos de 25 minutos (sin intentos) hasta más de 1 hora (con intentos) (Tierno de Figueroa, 1998).
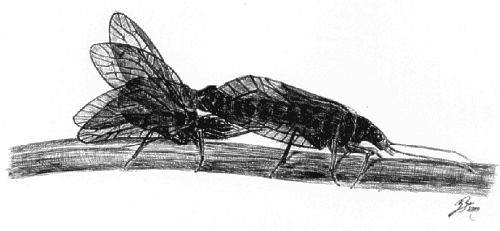
|
Fig. 2. Postura adoptada por los megalópteros durante la transmisión del espermatóforo (dibujo: Juan Ramón Fernández Cardenete). |
Tipos de apareamiento
Básicamente encontramos dos modos de transmisión del esperma: transmisión directa e indirecta o por espermatóforos. El primer caso es el más frecuente en los insectos acuáticos de las montañas mediterráneas. Para ello el macho adopta una posición característica, típicamente sobre la hembra (adoptando postura en paralelo o en X como hemos descrito en plecópteros, Tierno de Figueroa, 1998) y arqueando su abdomen bajo el de ésta o postura en sentidos opuestos uniendo los extremos de sus abdómenes (como ocurre en tricópteros, típulas y otros insectos). En todos los casos el macho introduce su estructura copuladora (pene o edeago, epiprocto, convector de esperma, etc) en el orificio genital de la hembra. En muchos casos el macho presenta estructuras asociadas que le permiten "abrir" el orificio femenino, elevando placas genitales y que garantizan la cópula entre individuos de la misma especie, actuando como mecanismos de aislamiento reproductivos o caracteres que evitan las cópulas erróneas entre individuos de distinta especie. En relación a la transmisión de espermatóforos (por ejemplo en megalópteros), tienen la ventaja de proporcionar un aporte proteico a la hembra, que transcurrido un espacio de tiempo variable (se ha comprobado que el tiempo que la hembra tarda en devorar el espermatóforo guarda relación con el tiempo necesario para que los espermatozoides pasen al interior del orifico genital de la hembra, Hayashi, 1999) es consumido por la hembra. La secuencia de aproximación y transmisión del espermatóforo en siálidos (megalópteros) ha sido descrita para varias especies (Elliott, 1996; Tierno de Figueroa y Palomino Morales, 1999) y puede ser resumida en la siguiente secuencia de eventos 1. El macho (a veces varios) persigue a la hembra introduciendo la cabeza bajo el abdomen de ésta. 2. Cuando ésta se detiene el macho eleva con su primer par de patas el abdomen de la hembra. 3. Gira su abdomen echando las alas a un lado para pegar el espermatóforo junto a la placa genital de la hembra y 4. Pasados unos instantes la abandona. Al cabo de un tiempo, concretamente en la especie estudiada por nosotros, Sialis nigripes Pictet, 1865, éste era superior a los 15 minutos, la hembra gira su abdomen bajo el cuerpo y lo devora (Tierno de Figueroa y Palomino Morales, 1999).
Cópulas erróneas
Podemos señalar también la existencia de comportamientos anómalos o erróneos de cópula (frecuentemente observados en nuestros estudios y señalados por otros autores). En relación con ello, podemos destacar que en casi todos los seres vivos de reproducción sexual, la evolución ha favorecido la aparición de mecanismos que aseguren la correcta identificación de la pareja, evitando así los costes derivados de los posibles errores. No obstante, son frecuentes, especialmente en condiciones no naturales, los intentos de cópulas "erróneos". Estos errores han sido observados en muchos grupos de insectos (Thornhill y Alcock, 1983), así como de otros animales como los anfibios (Thorn, 1968) o los mamíferos (Wendt, 1964), en estos últimos incluso con significado social se realizan simulacros de cópulas. Datos nuestros (Tierno de Figueroa, 1998) y bibliográficos, muestran la existencia de intentos de cópulas entre dos machos de una misma especie (lo que llamaríamos, quizá erróneamente, homosexualidad desde un punto de vista antropocéntrico) y de un macho de una especie con una hembra de otra (podríamos llamarlo irónicamente zoofília). Estos comportamientos sugieren la falta de feromonas de contacto en algunas especies, así como de selectividad y discriminación por parte de los machos (Zeigler, 1990). Se han observado también intentos de cópula de machos con hembras muertas (siguiendo con la ironía necrofilia) y los intentos de cópula de machos adultos con ninfas a punto de emerger también son posibles (para terminar con la pedofilia) (ver Tierno de Figueroa, 1998). No obstante, en la naturaleza el uso de comunicación intersexual y, quizá, diferencias en la elección de sustrato o en los períodos de vuelo, evitarían gran parte de esas cópulas erróneas, favoreciendo el encuentro entre individuos de la misma especie y, en el primer caso, de diferente sexo. La existencia de lugares de agregación y la formación de enjambres, si bien van a favorecer el encuentro entre individuos de diferente sexo, por otra parte favorecería también una mayor frecuencia de cópulas entre machos.
Los vuelos de compensación de la deriva por los reproductores
Uno de los hábitats de insectos acuáticos más típicos son los rápidos arroyos de las montañas, pero incluso en ríos más lentos, encontramos siempre un flujo de corriente que arrastra a las formas juveniles acuáticas aguas abajo (mecanismo de deriva). Este arrastre ha de ser compensado de algún modo y parece ser que el mecanismo de compensación más generalizado es la existencia de vuelos aguas arriba por parte de los adultos, concretamente las hembras previamente a la oviposición.
Oviposición
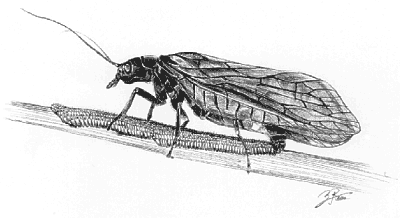
Con la liberación de los huevos u oviposición termina la tarea reproductora de los adultos de insectos acuáticos. Buena parte del éxito reproductor del individuo va a depender de la correcta ubicación de la puesta en el lugar adecuado. La mayor parte de los insectos acuáticos van a depositar la puesta directamente en el medio de agua dulce, generalmente liberándolos en la superficie del agua. Sin embargo existen algunos, como los megalópteros, que colocan la puesta a cierta altura del agua sobre la vegetación emergente (carrizos, juncos, etc) (concretamente y según nuestros estudios en torno a 1,20 metros en la especie Sialis nigripes Pictet, 1865; Tierno de Figueroa y Palomino Morales, 1999). Cuando las jóvenes larvas salen del huevo se dejan caer a la masa de agua y en caso de caer sobre suelo se arrastran hasta el agua (Elliott, 1996). Por último es destacable el caso de los tricópteros “buceadores”, capaces de sumergirse para buscar activamente lugares de oviposición (I. Ribera, comunicación personal).
En los insectos que liberan la masa de huevos en el agua, suelen aparecer huevos con estructuras de anclaje (discos de fijación, envolturas adherentes) que facilitan su fijación a las piedras del fondo o a la vegetación. La existencia de estos mecanismos de fijación facilitan protección a los huevos y les permiten en medios de aguas corrientes no sufrir una acusada deriva aguas abajo.
|
Fig. 3. Hembra de megalóptero depositando la puesta (dibujo: Juan Ramón Fernández Cardenete). |
En cuanto al desarrollo de los huevos y el tiempo necesario hasta la eclosión, se ha demostrado en diversos grupos de insectos acuáticos que existe una clara relación con la temperatura (e indirectamente con la altitud), lo que se denomina "grados-días" acumulativos necesarios para completar el desarrollo. Incluso se puede ajustar en muchas ocasiones a la ecuación de una recta como hemos comprobado en Sialis nigripes Pictet, 1865 (Tierno de Figueroa y Palomino Morales, 1999) y como se sabe que se da en otros insectos acuáticos como los plecópteros (Elliott, 1989, 1991) o en otros megalópteros (Elliott, 1996). Además el porcentaje de huevos eclosionados también depende de la temperatura, encontrándose un óptimo de temperatura, por encima y por debajo del cual el porcentaje de huevos eclosionados es menor (Elliott, 1996).
Las barreras geográficas. Fenómenos de aislamiento reproductivo y sus consecuencias
Generalmente ha sido señalado el hecho de que las montañas actúan como barreras o como islas favoreciendo fenómenos de especiación (formación de nuevas especies). Esto es especialmente evidente en el caso de las montañas mediterráneas, dado el efecto de las glaciaciones y otros procesos y fenómenos geológicos. Sirva como ejemplo el hecho de que, como ocurre en otros grupos animales y vegetales, hallemos en Sierra Nevada, especies de insectos acuáticos propias de latitudes mucho más norteñas o un buen número de endemismos.
En el caso de los insectos acuáticos, y especialmente en los grupos con escasa capacidad de dispersión, que raras veces se alejan de los medios acuáticos en los que viven (bien lagunas aisladas en la sierra o arroyos de valles acusados), es fácil que surjan fenómenos de especiación alopátrica o geográfica. Poblaciones que queden aisladas geográficamente (en las que ocurre una ruptura del flujo génico) pueden dar lugar a la aparición de nuevas subespecies o especies por la aparición de los llamados mecanismos de aislamiento reproductivos que evitarían si culminasen, y si las poblaciones volvieran a entrar en contacto, que se restableciera dicho flujo génico.
Los mecanismos de aislamiento reproductivo (MAR) han sido divididos en prezigóticos y postzigóticos, según ocurran antes o después de la formación del zigoto. Tan sólo por citar unos ejemplos, haremos referencia a algunos posibles MARs prezigóticos observables en especies muy afines de insectos acuáticos y que pudieran haber estado involucrados en la formación de especies. En este sentido hemos destacado en un estudio (Tierno de Figueroa y Sánchez-Ortega, 1999) la importancia de la diferenciación en los cantos de dos especies muy afines de plecópteros Isoperla grammatica (Poda, 1761) e Isoperla nevada Aubert, 1952 al actuar como mecanismo de aislamiento reproductivo prezigótico de tipo etológico. Como tipo mecánico, es frecuente en especies muy afines la existencia de "incompatibilidades en genitalia" por la existencia de complicadas genitalias de algunos insectos, con lóbulos, escamas, estructuras espatuladas diferentes entre especies afines para la correcta transmisión de esperma y para poder abrir el orificio genital de la hembra. Como aislamiento ecológico (diferentes nichos, diferente distribución), sirva como ejemplo los mosquitos Anopheles que ocupan en distintos tipos de agua según salinidad (Ayala, 1994). Y por ultimo, como aislamiento temporal, es frecuente la presencia de una diferente época de reproducción, como parece existir entre las distintas especies del genero Leuctra en Sierra Nevada, entre las que se observa un claro desplazamiento entre sus periodos de vuelo o al menos en sus máximos (Tierno de Figueroa, Luzón-Ortega y Sánchez-Ortega, ms).
A modo de breve conclusión
Sirva todo esto como una breve aproximación al conocimiento de la biología reproductora de los insectos acuáticos, un aspecto fundamental para conocer la dinámica de sus poblaciones y para gestionar su conservación, e indirectamente la de todo su entorno, ya que los insectos acuáticos son piezas clave en el funcionamiento de los ecosistemas de agua dulce. Además el conocimiento de la biología reproductora de estos organismos nos ofrece una perspectiva más amplia del fenómeno de la reproducción al basarse en pilares con cierta constancia en todo el reino animal.
Bibliografía
Abbott, J. C. y Stewart, K. W. 1993. Male search behavior of the stonefly, Pteronarcella badia (Hagen) (Plecoptera: Pteronarcyidae), in relation to drumming. Journal of Insect Behavior, 6(4): 467-481.
Alcock, J. y Gwynne, D. T. 1991. Evolution of insect mating systems: the impact of individual selectionist thinking. 10-41. En: Bailey & Ridsdill-Smith (ed ). Reproductive behaviour of insects. Chapman &Hall.
Ayala, F. J. 1994. La Teoría de la Evolución. Ed. Temas de Hoy. Madrid. 215 pp.
Brinck, P. 1949. Studies on Swedish Stoneflies (Plecoptera). Opuscula entomologica., suppl. 11: 1-250.
Bittain, J. E. 1990. Life histories strategies in Ephemeroptera and Plecoptera. 1-12. En: Campbell (ed). Mayflies and stoneflies: Life history and biology. Kluwer Academic Publishers.
Corbet, P. S. 1964. Temporal patterns of emergence in aquatic insects. Canadian Entomology, 96: 264-279.
Elliott, J. M. 1989. The effect of temperature on egg hatching for three populations of Dinocras cephalotes (Plecoptera: Perlidae). Entomologist`s Gazette, 40: 153-158.
Elliott, J. M. 1991. The effect of temperature on egg hatching for three populations of Perla bipunctata (Plecoptera: Perlidae). Entomologist`s Gazette, 42: 99-103.
Elliott, J. M. 1996. British freshwater Megaloptera and Neuroptera: A key with ecological notes. Freshwater Biological Association, Scientific Publication, N. 54: 68 pp
Hayashi, F. 1999. Rapid evacuation of spermatophore contents and male post-mating behaviour in alderflies (Megaloptera: Sialidae). Entomological Science, 2(1): en prensa.
Hutchinson, G. E. 1981. Throughts on aquatic insects. BioScience, 31(7): 495-500.
Ivanov, V. D. y Rupprecht, R. 1992. Substrate vibration for communication in adult Agapetus fuscipes (Trichoptera: Glossossomatidae). 273-278. Proceedings, VII International Symposium Trichoptera, Umea, Sweden.
Luzón-Ortega, J. M., Tierno de Figueroa, J. M. y Sánchez-Ortega, A. 1998. Faunística y fenología de los plecópteros (Insecta, Plecoptera) de la Sierra de Huétor (Granada, España). Relación con otras áreas del sur de la Península Ibérica y norte de África. Zoologica baetica, 9: 91-106.
Nebeker, A. V. 1971. Effect of temperature at different altitudes on the emergence of aquatic insects from a single stream (Ple.). Journal of Kansas entomological Society, 44(1): 26-35.
Peckarsky, B. L. y Cowan, C. A. 1991. Consequences of larval intraspecific competition to stonefly growth and fecundity. Oecologia, 88: 277-288.
Rupprecht, R. 1975. Die Kommunikation von Sialis (Megaloptera) durch vibrationssignale. Journal of Insect Physiology, 21: 305-320.
Saeten, M. y Brittain, J. E. 1985. Life cycles and emergence of Ephemeroptera and Plecoptera from Myrkdalsvatn, an oligotrophic lake in western Norway. Aquatic Insects, 7(4): 229-241.
Stewart, K. W. 1997. Vibrational communication in insects. Epistome in the languaje of stoneflies? American Entomologist, summer 1997: 81-91.
Stewart, K. W. y Zeigler, D. D. 1984. The use of larval morphology and drumming in Plecoptera systematics, and further studies of drumming behavior. Annals of Limnology, 20(1-2): 105-114.
Sweeney, B. W. 1984. Factors influrencing life-history patterns of aquatic insects. 56-100. En: Resh & Rosenberg (ed). Ecology of Aquatic Insects. Praeger Publishers.
Thorn, R. 1968. Les salamandres d`Europe, d`Asie et d`Afrique du Nord. Paul Chevalier. París.
Thornhill, R. y Alcock, J. 1983. The evolution of insect mating systems. Harvard University press. 547 pp.
Tierno de Figueroa, J. M. 1998. Biología imaginal de los plecópteros (Insecta, Plecoptera) de Sierra Nevada (Granada, España). Tesis doctoral inédita. Universidad de Granada. 312 pp.
Tierno de Figueroa, J. M., Luzón-Ortega, J. M. y Sánchez-Ortega, A. 2000. Calling, mating and oviposition in Isoperla curtata (Plecoptera, Perlodidae). European Journal of Entomology: en prensa.
Tierno de Figueroa, J. M., Luzón-Ortega, J. M. y Sánchez-Ortega, A. Fenology of stoneflies (Insecta, Plecoptera) in Sierra Nevada. ms.
Tierno de Figueroa, J. M. y Palomino Morales, J. A. 1999. Biología de los adultos y huevos de Sialis nigripes Pictet, 1865 (Megaloptera, Sialidae). XVII Jornadas de la Asociación española de Entomología. Resúmenes de conferencias y comunicaciones, 44.
Tierno de Figueroa, J. M., Pérez, T. y Sánchez-Ortega, A. 1996. Composición faunística y fenología de los plecópteros (Insecta: Plecoptera) de la Serranía de Ronda. Boletín de la Asociación española de Entomología, 20(3-4): 47-58.
Tierno de Figueroa, J. M. y Sánchez-Ortega, A. 1999. The male drumming call of Isoperla nevada Aubert, 1952 (Plecoptera, Perlodidae). Aquatic Insects, 21(1): 33-38.
Wendt, H. 1964. La vida sexual de los animales. Ed. Noguer. Barcelona. 424 pp.
Wiley, M. J. y Kholer, S. L. 1984. Behavioral adaptations of aquatic insects. 101-133. En: Resh & Rosenberg (ed). Ecology of Aquatic Insects. Praeger Publishers.
Zeigler, D. D. 1990. Observations pertinent to the role of sexual selection in the stonefly Pteronarcella badia (Plecoptera: Pteronarcyidae). Entomological News, 101(5): 283-287.