Aracnet 9 - Bol. S.E.A., nº 30 (2002) : 187-195.
METODOLOGÍAS
Técnicas básicas de anatomía microscópica y de morfometría para estudiar los Insectos
Imelda Martínez M.
Instituto de Ecología, A.C. Departamento de Ecología
y Comportamiento Animal.
Apartado Postal 63. 91000 Xalapa, Ver. México.
email: imelda@ecologia.edu.mx
Resumen: Se presentan las técnicas más sencillas y comúnmente empleadas para estudiar la micro-anatomía y la morfometría en insectos. Estas técnicas han sido adecuadas principalmente para el estudio del aparato reproductor. Las técnicas de micro-anatomía más usuales son las efectuadas in toto, en las cuales se estudian enteros el individuo o el órgano y las técnicas histológicas que permiten un análisis más profundo a nivel de tejido. Las técnicas morfométricas toman en consideración, además de las medidas, el estado funcional de los órganos directamente implicados en la reproducción para valorar indirectamente su estado fisiológico.
Palabras clave: Técnicas, Anatomía, Histología, Morfometría, Fisiología, Insectos.
Introducción
Los insectos están representados por aproximadamente un millón de especies conocidas. Entre ellos, el grupo de los Coleoptera Scarabaeoidea conocidos comúnmente como escarabajos, es uno de los “mejor conocidos”; sin embargo, la información que se tiene sobre las 30.000 especies catalogadas a nivel mundial, pocas veces supera el nivel morfológico descriptivo común para la taxonomía alfa (Morón et al., 1997).
Estudiando diversos aspectos de la reproducción, principalmente en Coleoptera (Scarabaeidae) y en Diptera (Tephritidae), se fueron seleccionando durante años varias técnicas básicas de morfometría y de anatomía microscópica que se encuentran dispersas en la literatura, con la finalidad de efectuar estudios morfológicos o morfo-funcionales. Estas técnicas han sido adecuadas principalmente para estudiar la anatomía de los aparatos reproductivos y para analizar morfo-funcionalmente la actividad reproductiva en varias especies. Empleando estas técnicas anatómicas y combinándolas con técnicas de morfometría muy simples, se ha determinado el estado de madurez sexual de los individuos en una población dada, la actividad gonádica y de otros órganos relacionados con la reproducción, así como el establecimiento de los ciclos reproductores en varias especies (Martínez, 1992a, 1992b, 1994, 1995; Martínez & Cruz, 1992, 1998, en prensa: Martínez & Montes de Oca, 1994; Martínez et al., 1995; Martínez & Huerta, 1997; Martínez & Hernández Ortiz, 1997; Cruz et al., en prensa).
Desde hace más de 10 años, estas técnicas han sido indicadas a numerosos colegas y estudiantes dando muy buenos resultados en insectos y en otros grupos de animales, para su empleo tanto en el estudio del aparato reproductor como de otros sistemas anatómicos. Debido a esto, se consideró importante hacer una síntesis de las técnicas de microanatomía, aparecida ya en Folia Entomológica Mexicana (Martínez, 1999) y de las técnicas de morfofisiología más sencillas y más comúnmente usadas, que se presentan juntas en esta publicación, esperando que los procedimientos técnicos que se describen sean de utilidad en el quehacer entomológico.
Las técnicas microanatómicas
La anatomía microscópica es de gran utilidad para los estudios del desarrollo preimaginal e imaginal o para estudiar los órganos aislados, ya sea con fines taxonómicos, morfológicos o morfo-funcionales.
Las técnicas más usuales en los estudios de anatomía microscópica se dividen en dos grandes grupos. Las técnicas in toto, con las cuales el individuo o el órgano se estudia completo, incluyendo las técnicas de coloración para estructuras cuticulares, y las técnicas histológicas con las que el individuo o el órgano es estudiado en cortes histológicos.
• Técnicas in toto.
Estas técnicas se logran bien sólo en embriones, larvas o en órganos aislados del individuo, de un grosor que no exceda de aproximadamente un milímetro, de manera tal que puedan ser transparentados adecuadamente para poder observar por transparencia la estructura fina.
Obtención de la muestra y fijación. Los embriones, larvas, pupas o los órganos por estudiar deben ser obtenidos en una solución salina, de preferencia en Ringer para insectos para evitar la retracción de los tejidos. En dicha solución el individuo o la pieza aislada para estudiar deben ser disecados y limpiados.
[Ringer: Cloruro de sodio, 0,5 gr. Cloruro de potasio, 0,25 gr. Cloruro de calcio, 0,30 gr. Bicarbonato de sodio, 0,20 gr. Agua destilada, 1000 ml (Langeron, 1969)].
El paso siguiente es colocar la pieza en un líquido fijador, el cual actúa conservando los tejidos y la células en el estado más aproximado posible a como se encuentran en el individuo vivo. El fijador que mejor resultado ha dado en los insectos, debido a que penetra muy bien en los tejidos, es el AFATD. Este fijador dura sólo unos 4 días en refrigeración. La duración de la fijación es de una a dos horas; el tiempo óptimo es de dos horas, siempre y cuando la pieza no pase de un tamaño de aproximadamente tres mm3. El volumen de fijador debe ser al menos de ocho veces el volumen de la pieza. Al término de la fijación, para eliminar el fijador, la pieza se lava en alcohol de 96º donde se puede guardar varios días o algunas semanas, aunque hay que evitar que el tiempo sea prolongado para que las piezas no se retraigan demasiado.
[AFATD: Mezcla de Alcohol de 96º, 75 ml. Formaldehído, 10 ml. Ácido acético, 5 ml. Dimetilsulfóxido, 10 ml. y Ácido tricloracético, 1gr. El dimetilsulfóxido permite la mejor penetración del fijador (Carayon, J. Comunicación personal)].
También se puede usar como fijador el Carnoy. Este fijador debe ser preparado en el momento de usar y de preferencia no guardarlo. El tiempo de fijación es de 24 h mínimo. Después de lo cual la pieza se lava y se puede guardar en alcohol de 96º hasta su tinción con la técnica escogida. Como para el AFATD, se debe evitar la permanencia prolongada de la pieza en el alcohol de 96º.
[Carnoy: Mezcla de Alcohol absoluto, 60 ml. Cloroformo, 30 ml. Ácido acético, 10 ml (Gabe, 1968)].
• Tinción y montaje in toto.
Después del lavado del fijador, se seguirá con la técnica de tinción escogida, que será seguida por una deshidratación, una transparentación y el montaje definitivo sobre un portaobjetos en bálsamo de Canadá de preferencia, para que las preparaciones se conserven durante años. En cambio, si se usa resina sintética, en muy poco tiempo este medio de montaje se cristaliza, su coloración se obscurece y se pierde fácilmente la coloración de las piezas. Para la tinción existen diferentes variantes, desde el empleo de un solo colorante como el verde luz, el azul de toluidina o la técnica de Feulgen-verde luz, que es más complicada, pero más durable, además de que es la que mejores resultados ha dado.
Tinción con verde luz o azul de toluidina. Después de la fijación, la pieza debe ser hidratada: la pieza guardada en alcohol de 96º, se pasa a alcohol 70º durante cinco minutos y después a agua destilada durante cinco a diez minutos. La pieza se pasa a la solución de verde luz durante un minuto o a la solución de azul toluidina durante 10 minutos. Posteriormente se deshidrata pasando por dos cambios muy rápidos de alcohol de 96º, para evitar que el colorante se diluya completamente en el alcohol. Después se hacen dos cambios de 10 minutos cada uno de alcohol absoluto y dos cambios de 10 minutos en tolueno. Finalmente, la pieza se monta y se orienta sobre un portaobjetos, en bálsamo de Canadá y se cubre con un portaobjetos.
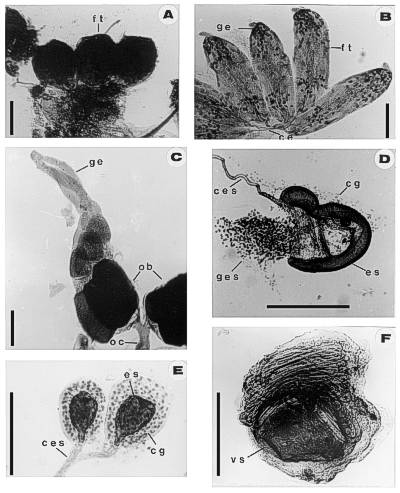
Resultados: todos los tejidos se tiñen de verde o azul-verdoso según el colorante empleado, aunque sin mucho contraste, ni definición de estructuras como los núcleos, por ejemplo. Esta técnica funciona bien con piezas muy pequeñas, que no pasen de un milímetro de tamaño y pueden ser empleadas cuando no se necesita mucha definición de las microestructuras (Fig. 1A).
[Reactivos: Verde luz, 0,01 gr en 100 ml de agua destilada; Azul de toluidina, 0,5 gr en 100 ml de agua destilada (Martoja, 1967)].
|
|
Tinción con Feulgen-verde luz. Esta técnica es una modificación a la empleada por Morgan (1971). La pieza de estudio debe ser lavada e hidratada después de la fijación, pasando por alcohol de 96º, alcohol de 70º, hasta llegar a agua destilada. Cada cambio debe ser de al menos cinco minutos. Después, la pieza se hidroliza en ácido clorhídrico normal a 60ºC durante 5 a 8 minutos, según el tamaño de la pieza. Pasar la pieza al reactivo de Schiff y dejarla de 30 a 45 minutos, de preferencia a la obscuridad y en un recipiente tapado. Quitar el reactivo de Schiff (que se puede guardar para volver a usar) y lavar la pieza en agua corriente, mínimo durante cinco minutos, hasta que se elimine la coloración en el agua de lavado. Lavar en agua destilada durante cinco minutos haciendo varios cambios. Pasar a la solución de verde luz durante 10 segundos. Lavar rápidamente en alcohol de 96º y pasar a alcohol absoluto. Hacer dos cambios de alcohol absoluto de 10 minutos cada uno. Después dos cambios de tolueno de 10 a 15 minutos cada uno. Montar en un portaobjetos en bálsamo de Canadá y cubrir con un cubreobjetos.
Resultados: el DNA de los núcleos se tiñen selectivamente con el reactivo de Schiff dando una coloración roja intensa (Pearse, 1968), el resto de los tejidos se tiñen con el verde luz. Esta técnica funciona muy bien en órganos y sistemas completos, pequeños, como las gónadas o los aparatos reproductores de insectos (Fig. 1B, 1C, 1D).
[Reactivos: Ácido clorhídrico normal: ácido clorhídrico concentrado, 83,3 ml y con agua destilada aforar a 1000 ml. Reactivo de Schiff: disolver 2,5 gr. de Pararosanilina en 75 ml de ácido clorhídrico normal. Por separado, disolver 2,5 gr de metabisulfito de sodio en 425 ml de agua destilada. Mezclar las dos soluciones y dejar reposar durante 24 horas a temperatura del laboratorio, bien tapado y en la obscuridad. Después de ese tiempo, si la mezcla no está transparente, agregar 1,5 gr de carbón activado, agitar enérgicamente, dejar reposar y filtrar. Guardar en frasco ambar, de preferencia en el refrigerador. Dura hasta 3 meses o más. Verde luz: 0,01 gr de verde luz en 100 ml de agua (Gabe, 1968; Martoja & Martoja, 1967)].
Tinciones con Negro de Clorazol. Esta tinción se usa para teñir el esqueleto cuticular de los insectos, entero o en partes aisladas. El negro de clorazol en un colorante que se fija extraordinariamente a la cutícula dando diferentes tonos de coloración que hacen aparecer los más finos detalles (Carayon, 1969).
La pieza a estudiar, que puede estar fijada o simplemente estar seca, deberá ser macerada en una solución de potasa, lavada, teñida, deshidratada, transparentada y guardada en algún líquido conservador o montada en bálsamo de Canadá. Dependiendo de la pieza y el fin que tenga el estudio, existen diferentes variantes de la técnica.
Si el insecto está completo o la pieza es grande, la maceración se hace colocándolos en una solución acuosa de hidróxido de potasio al 10 %. Se puede calentar para acelerar la maceración, sólo hay que evitar que se deshaga la pieza que se va a estudiar. Después lavar abundantemente en agua destilada para detener la maceración. Posteriormente, depigmentar durante 15 minutos o más en peróxido de hidrógeno de 30 volúmenes más unas gotas de hidróxido de amonio, hasta que la cutícula esté blanca y lavar abundantemente en agua destilada. En este paso se puede hacer la disección fina, separando las partes importantes para estudiar. Colocar las piezas disecadas en lactofenol o alcohol benzílico con algunas gotas de negro de clorazol en solución y dejarlas en el reactivo hasta que tomen la coloración deseada. Bajo el microscopio controlar la coloración y terminar la disección. Pasar la pieza a alcohol de 96º y hacer dos cambios de 10 minutos. Hacer tres cambios en alcohol absoluto de 10 minutos y tres cambios de tolueno de 10 minutos cada uno. Montar y orientar en bálsamo de Canadá sobre un portaobjetos y cubrir con un cubreobjetos.
En cambio, si las piezas son pequeñas, de menos de 0,5 mm, la maceración y la coloración se pueden hacer al mismo tiempo. En este caso, colocar las piezas en un portaobjetos excavado con una solución acuosa al 1% de hidróxido de potasio frío y unas gotas de la solución de negro de clorazol. Bajo el microscopio se va haciendo la disección y controlando la maceración hasta separar la pieza que interesa, que se va tiñendo al mismo tiempo. Cuando la tinción es la deseada, se pasa por varios cambios de agua destilada, para eliminar completamente el hidróxido de potasio. Después, se pasa a lactofenol o alcohol benzílico para que se transparenten. Aún en este paso de la tinción, si es necesario que las piezas se tiñan más, se pueden agregar otras gotas de negro de clorazol y seguir observando y disecando. Cuando la pieza adquiere la coloración deseada, pasarla a alcohol de 96º y hacer tres cambios de cinco minutos cada uno. Hacer tres cambios de alcohol absoluto de cinco minutos cada uno. Hacer tres cambios de tolueno o xileno de cinco minutos cada uno. Montar la pieza en bálsamo de Canadá en un portaobjetos y colocar el cubreobjetos.
|
|
Resultados: la cutícula toma el color de azul a negro según el grosor de la cutícula y el tiempo de exposición al colorante (Fig. 2A, 2B). Si no se quiere hacer el montaje definitivo en bálsamo de Canadá, las piezas se pueden guardar indefinidamente en lactofenol o en alcohol benzílico para observar directamente en el microscopio, sólo hay que evitar que el lactofenol o el alcohol benzílico se evaporen.
[Reactivos: Potasa: 10 gr de hidróxido de potasio en 100 ml de agua destilada. Solución de negro de clorazol: 1 gr de negro de clorazol en 100 ml de alcohol de 70º (Carayon, 1969)].
• Técnicas histológicas.
Para los estudios a nivel histológico, los individuos o parte de ellos, según el tipo de estudio, deberán ser fijados y lavados. El fijador que mejores resultados ha dado para la histología de insectos es el Bouin acuoso. La duración de la fijación es de 24 horas, siempre y cuando la pieza no mida más de cinco mm3. Posteriormente pasar a alcohol de 70º y hacer varios cambios de lavado hasta eliminar el amarillo del ácido pícrico. Las piezas pueden durar de varios días a semanas en este paso, pero hay que evitar una estancia prolongada para evitar que las piezas se endurezcan. También se puede usar el AFATD (ver en las técnicas in toto).
[Bouin: Solución acuosa saturada de ácido pícrico, 75 ml. Formaldehído, 25 ml. Ácido acético, 5 ml que se agrega de preferencia al usar (Gabe, 1968; Martoja & Martoja, 1967)].
Posteriormente las piezas se deberán incluir en parafina y hacer los cortes histológicos seriados, generalmente de seis a ocho µm, con un microtomo. Los cortes histológicos seriados deberán ser colocados y extendidos sobre un portaobjetos, después serán desparafinados, hidratados, teñidos, deshidratados, transparentados y montados en bálsamo de Canadá.
Inclusión en parafina. Una técnica corta y de las más simples es la inclusión en parafina sola. Después de lavar el fijador, se efectúan dos cambios de alcohol de 96º de 30 minutos cada uno. Seguir con tres cambios en alcohol absoluto de 30 minutos cada uno. Pasar a una mezcla de alcohol absoluto-alcohol butílico durante 30 minutos (2/3 de alcohol absoluto y 1/3 de alcohol butílico) y después a la mezcla de alcohol absoluto-alcohol butílico otra ½ hora (1/3 de alcohol absoluto y 2/3 de alcohol butílico). Dejar en alcohol butílico de 45 minutos a 24 horas, que es el tiempo óptimo. Pasar a alcohol butílico-tolueno (mezcla de 1-1) durante ½ hora. Después hacer tres cambios de parafina del mismo punto de fusión (de 58º a 60º C) de una hora cada uno, en una estufa a 60ºC. Posteriormente incluir y orientar la pieza en parafina del mismo punto de fusión, caliente y limpia, fuera de la estufa y de ser necesario a la lupa. Pasar los bloques de parafina, bruscamente, a un baño de agua fría para solidificarla (usar de preferencia parafina Histosec® de Merk, que es la que mejor penetra en los tejidos de insectos). Los tiempos en los reactivos están calculados para piezas pequeñas de aproximadamente tres mm3, si la pieza es más grande habrá que duplicar los tiempos en cada reactivo.
Otra técnica, que es la que mejores resultados ha dado, es una modificación de la doble inclusión en celoidina-parafina, y es recomendable para cualquier tamaño de pieza (Gabe, 1968, Carayon, J., comunicación personal). Después de la fijación en AFATD o en Bouin y los lavados posteriores en alcohol, pasar la pieza por dos o tres cambios de alcohol de 96º de mínimo una hora cada uno. Hacer tres cambios de alcohol absoluto de una hora cada uno. Dos cambios en alcohol isobutílico de 12 horas cada uno y si es posible a 40ºC. Un cambio en benzoato de metilo de 30 minutos. Dejar la pieza al menos 24 horas en la solución de celoidina. Pasar rápidamente por tolueno y colocar en parafina de 58º a 60º C de punto de fusión a 60º C. Impregnar en parafina en la estufa a 60ºC haciendo tres cambios en la parafina del mismo punto de fusión que pueden variar de 6 a 12 horas según el tamaño de la pieza. Para incluir y orientar la pieza usar parafina nueva, caliente y después enfriar bruscamente en agua fría. Las piezas incluidas en parafina se conservan indefinidamente. No olvidar poner la etiqueta con las referencias de la pieza incluida.
[Solución de celoidina: un gr de celoidina en 100 ml de benzoato de metilo (Carayon, J. comunicación personal)].
Elaboración de cortes histológicos seriados. Fijar la inclusión en un portaobjetos del microtomo. Orientar la pieza y eliminar con una navaja de hoja fina, el exceso de parafina alrededor. Hacer cortes de 6 a 8 m de grosor dependiendo del tipo de estudio a hacer. Recibir la tira de cortes, cortar tiras del tamaño del cubreobjetos que se vaya a usar y alinearlos sobre el portaobjetos en orden como si se fuera a leer, no perder cortes. Con una pipeta Pasteur inyectar bajo los cortes la cantidad suficiente de líquido de Ruyter para que floten y se extiendan. Colocar el portaobjetos sobre una platina caliente, extender los cortes, retirar de la platina caliente, dejar enfriar, retirar el exceso de líquido de Ruyter y dejar secar de dos a tres horas en la estufa a 60ºC. Los cortes quedan adheridos al portaobjetos. No olvidar numerar consecutivamente los portaobjetos usados para una misma pieza.
[Reactivos: Líquido de Ruyter: mezclar la solución de 10 ml de acetona más 10 gotas de benzoato de metilo, con una solución de 80 ml agua destilada con 20 gotas de albúmina glicerinada. Esta solución final se conserva varias semanas en el refrigerador. Albúmina glicerinada: Disolver un gr de ovoalbúmina en polvo en 100 ml de agua destilada y agregar 100 ml de glicerina. Filtrar y para conservar la solución agregar un gr de timol disuelto en algunas gotas de agua destilada. Se conserva en el refrigerador hasta más de 6 meses (Martoja & Martoja, 1967)].
Tinción y montaje de los cortes. Antes de iniciar la tinción colocar los cortes en la estufa a 60º C durante unos 20 minutos, hasta que la tira de parafina se funda. Después hay que desparafinar e hidratar los cortes. Pasar a tolueno, haciendo dos cambios de cinco minutos. Hacer dos cambios de 10 minutos en alcohol de 96º, un cambio en alcohol de 70º de 10 minutos y dejar en agua destilada al menos cinco minutos.
La coloración que más se ha empleado debido a los buenos resultados que proporciona para la histología de insectos es la de PAS-hematoxilina, además de que da algunas indicaciones histoquímicas. Los cortes se desparafinan e hidratan hasta llegar a agua destilada, como se indicó en la técnica anterior. Tratar los cortes en una solución acuosa de ácido peryódico al 1 % durante 10 minutos. Lavar en agua destilada durante cinco minutos. Tratar los cortes con el reactivo de Schiff durante 15 minutos en recipiente bien cerrado. Lavar durante cinco minutos en agua corriente, después en agua destilada varias veces, hasta desaparecer la coloración rosada de la reacción de Schiff. Dejar 10 minutos en una solución acuosa de alumbre de fierro al 5 % en una estufa a 40º C. Lavar en agua destilada durante cinco minutos. Teñir en hematoxilina de Heidenhain de uno a dos minutos. Después de la hematoxilina, pasar rápidamente por la mezcla diferenciadora de ácido pícrico. Pasar los cortes a agua corriente y controlar la diferenciación bajo el microscopio. Sólo los núcleos deben estar azules, los otros tejidos en tonos de rojo a rosado. Pasar a una solución saturada de carbonato de litio en agua corriente para virar la coloración de los núcleos a azul intenso. Lavar en agua corriente durante cinco minutos y después en agua destilada, cinco minutos. Deshidratar pasando por dos cambios de alcohol de 96º de 10 minutos, tres cambios de alcohol absoluto de 15 minutos y transparentar haciendo dos cambios de tolueno de mínimo 15 minutos cada uno. Montar en bálsamo de Canadá.
Resultados: Los núcleos se tiñen en azul oscuro. Los polisacáridos, particularmente el glucógeno, se tiñen selectivamente en rojo (Pearse, 1968) y los tejidos en rosado (Fig. 3).
[Reactivos: Hematoxilina de Heidenhain para teñir: 10 ml de solución madre de hematoxilina más 90 ml de agua destilada. La solución madre está hecha de 10 gr de hematoxilina en 100 ml de alcohol de 96º, envejecida en frasco ambar, a temperatura ambiente, al menos durante 3 meses. Mezcla diferenciadora: 1/3 de alcohol de 70º y 2/3 de solución saturada de ácido pícrico en alcohol de 70º (Gabe, 1968; Martoja & Martoja, 1967)].
|
|
Las técnicas de morfometría
La anatomía microscópica y la morfometría son técnicas complementarias que hemos usado principalmente para determinar el estado de madurez sexual de un individuo, para establecer el estado de madurez reproductiva de una población en un momento determinado y para definir los ciclos reproductivos.
Para los estudios de morfometría, es conveniente que la muestra que se va a examinar sea de un mínimo de seis a 10 individuos escogidos a azar, de cada sexo y de cada especie, en un momento determinado de comportamiento, de edad, o de época del año, dependiendo del tipo de estudio que se llevará a cabo. Para conocer el estado de actividad de los órganos reproductores o el estado de madurez sexual en ambos sexos, cada individuo deberá ser disecado en solución salina de Ringer Ephrussi para obtener los aparatos reproductores que serán fijados en el líquido fijador de AFTAD o de Carnoy y enseguida conservados en alcohol de 96º.
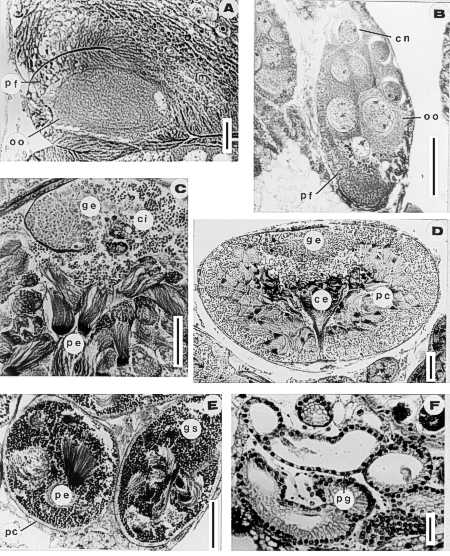
De cada uno de los individuos se dibujarán a escala, bajo el fotomicroscopio y con ayuda de la cámara clara, los principales órganos de los aparatos reproductores, como son las ovariolas, los testículos y los reservorios de las glándulas accesorias. Posteriormente, los aparatos reproductores pueden ser teñidos in toto con Feulgen-Verde luz y montados en bálsamo de Canadá para conservarlos indefinidamente en preparaciones fijas.
Después de hacer los dibujos correspondientes y obtener las medidas reales de cada uno de los órganos que se van a examinar, se puede hacer una valoración fisiológica indirecta considerando los datos morfométricos indicativos del estado en que se encuentran los principales órganos implicados en la reproducción.
En las hembras, uno de los procesos fisiológicos más importantes que se lleva a cabo durante la época reproductiva es la vitelogénesis, esto es la formación e incorporación del vitelo en los ovocitos en maduración y la maduración final de ellos incluyendo la coriogénesis o formación del corion antes de la oviposición (Wigglesworth, 1953; Bonhag, 1958; Engelmann, 1970).
Considerando estos antecedentes fisiológicos, en las hembras se han definido tres estadios de madurez tomando en cuenta la presencia o ausencia de ovocitos basales en las ovariolas, así como la longitud y la presencia o ausencia de corion de los ovocitos basales en cada ovariola. La ausencia de ovocitos basales es indicativo de que el ovario no ha madurado, la vitelogénesis no ha comenzado y la hembra está inmadura (Fig. 4A). La longitud de los ovocitos basales son un buen parámetro que permite evaluar la cantidad de vitelo formado durante la vitelogénesis; si la hembra está en maduración, los ovocitos presentarán tamaños crecientes, hasta obtener el tamaño anterior al del ovocito maduro de la especie (Fig. 4B,4C, 4D). Si se trata de una hembra madura antes de oviponer, los ovocitos basales, están maduros, han terminado la vitelogénesis, presentan la talla mayor y tienen corion, que es una membrana acelular translúcida, generalmente refringente, fácilmente visible (Fig. 4E). En las hembras después de la oviposición, los ovocitos que quedan en la base de la ovariola son pequeños, están madurando y por lo tanto están en vitelogénesis y no tiene corion (Fig. 4F).
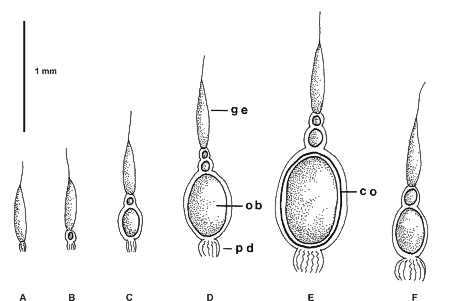
Fig. 4. Estado de cada una de las nueve ovariolas, de cada uno de los dos ovarios, en Aphodius opisthius Bates, en los diferentes estados de maduración. A, en las hembras inmaduras. B, C, D, en las hembras en maduración. E, en las hembras maduras antes de oviposición y F, en las hembras maduras después de la oviposición. (co, corion. ge, germario. ob, ovocito basal. pd, pedicelo). |
La variación en el tamaño de los ovocitos basales según el estado de madurez de las hembras, se observa claramente cuando se agrupan las medidas obtenidas. Los valores obtenidos en cada una de las especies que se han estudiado, son muy indicativos para determinar cada uno de los estados de madurez de las hembras en una población de estudio (Tabla I). Con estos datos se puede establecer después el ciclo reproductor, considerando el estado de madurez de las hembras en cada mes del año o del período de estudio. También se observa claramente la variación morfométrica cuando se analiza la evolución del ovario en cada uno de los períodos del comportamiento en que se encuentren las hembras de una especie determinada (Tabla II).
Tabla I. Características de cada estado de madurez sexual encontrados en las hembras de Ataenius apicalis (Aphodiidae: Eupariinae) considerando en cada una: el número de ovocitos en cada una de las ocho ovariolas de cada ovario, la longitud de los 16 ovocitos basales y si los ovocitos basales estaban o no corionados. (n) número de hembras por grupo. (*) ovocitos basales con corion (Datos tomados de Martínez & Cruz, en prensa).
|
ESTADOS DE MADUREZ |
(n) |
OVOCITOS |
OVOCITO BASAL |
|
INMADURAS |
14 |
0 |
|
|
EN MADURACIÓN |
11 |
1 |
0,146 ± 0,05 |
|
|
13 |
2 |
0,375 ± 0,03 |
|
|
6 |
3 |
0,442 ± 0,03 |
|
MADURAS |
|
|
|
|
antes oviposición |
24 |
3 |
0,675 ± 0,02 * |
|
después oviposición |
13 |
2 |
0,565 ± 0,05 |
|
|
49 |
3 |
0,607 ± 0,06 |
Tabla II. Evolución del ovocito basal en el vitelario de dos especies de Canthon (Scarabaeidae: Scarabaeinae) durante los principales períodos comportamentales de la vida imaginal. (*) el cuidado del nido se presenta sólo en Canthon cyanellus cyanellus. (n) número de hembras por grupo (Datos tomados de Martínez, 1995).
|
PERIODOS |
OVOCITO BASAL longitud: x ± se (mm) |
||
|
C. indigaceus chevrolati |
C. cyanellus cyanellus |
||
|
PRENIDIFICACIÓN |
|
|
|
|
|
emergencia |
no existe |
no existe |
|
|
a medio período |
1,3 ± 0,2 (5) |
1,1 ± 0,2 (5) |
|
|
al final del período |
3,3 ± 0,1 (5) |
2,8 ± 0,1 (5) |
|
|
|||
|
NIDIFICACIÓN |
|
|
|
|
|
antes de oviposición |
4,2 ±0,2 (5) |
3,1 ± 0,1 (5) |
|
|
después de oviposición |
2,4 ± 0,2 (5) |
2,2 ± 0,1 (5) |
|
|
durante cuidado de nido* |
|
1,0 ± 0,1 (5) |
|
|
|||
|
POSNIDIFICACIÓN |
0,5 ± 0,1 (5) |
0,8 ± 0,2 (5) |
|
|
|
|||
En los machos, después de la espermatogénesis, el proceso fisiológico más importante es la síntesis de las secreciones de las glándulas accesorias que son almacenadas en los reservorios glandulares. Estas secreciones, con los espermatozoides, formarán gran parte del espermatóforo durante la cópula (Mann, 1984; Chen, 1984; Davey, 1985).
Así, en los machos también se han considerado tres estados de madurez tomado en cuenta la longitud de los folículos testiculares y el volumen de los reservorios de las glándulas accesorias. Los folículos testiculares son pequeños, y los reservorios también, además de que no contienen secreciones de las glándulas accesorias, en los machos inmaduros (Fig. 5A). Durante la maduración de los machos, los folículos y los reservorios glandulares aumentan paulatinamente de tamaño y volumen, además de que en el reservorio se han ido almacenado secreciones (Fig. 5B, 5C). En los machos maduros antes de copular, los folículos testiculares alcanzan su máxima longitud y los reservorios su máximo volumen ya que están llenos de secreciones. Después de la cópula, tanto los folículos testiculares como los reservorios disminuyen en tamaño (Fig. 5D, 5E).
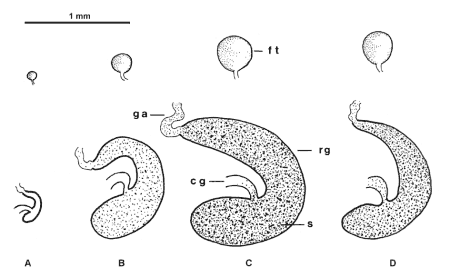
Fig. 5. Estado de cada uno de los siete folículos testiculares y de cada uno de los dos reservorios de las glándulas accesorias en Aphodius opisthius Bates, en los diferentes estados de maduración. A, en los machos inmaduros. B, durante la maduración. C, en los machos maduros antes de la cópula. D, en los machos maduros después de la cópula. (cg, conducto glandular. ft, folículo testicular. ga, glándula accesoria. rg, reservorio glandular. s, secreciones). |
En los machos también podemos observar las modificaciones de los órganos medidos dependiendo del estado de madurez en que se encuentren. Las modificaciones en el testículo son claras, pero en la mayoría de los casos que hemos analizado, las modificaciones más aparentes se presentan en los reservorios de las glándulas accesorias (Tabla III). Teniendo los valores correspondientes a cada estado de madurez, se puede establecer el ciclo reproductivo determinando el estado de madurez de los individuos en cada mes del año, como en el caso de las hembras. Por otro lado, si lo que se analiza son las variaciones presentes en los órganos reproductivos durante los diferentes períodos del comportamiento, en una especie dada, los valores que se obtienen son bastantes determinativos para cada período (Tabla IV).
Tabla III. Estados de madurez encontrados en los machos de Aphodius opisthius (Aphodiidae: Aphodiinae) considerando en cada uno: la longitud de los siete folículos testiculares de cada testículo, y el volumen y contenido de secreciones de cada uno de los dos reservorios glandulares. (-) sin secreciones, (+) con cantidad baja, (++) regular, o (++) alta de secreciones. (n) número de machos examinados por grupo (Datos tomados de Alvarado, 2001).
|
ESTADOS DE MADUREZ |
n |
Folículos Testiculares |
Reservorios Glandulares |
||
|
longitud (mm) |
volumen |
secreciones (cantidad) |
|||
|
INMADUROS |
38 |
0,113 ± 0,03 |
4,16 ± 2,3 |
(-) |
|
|
EN MADURACIÓN |
7 |
0,218 ± 0,01 |
41,68 ± 5,9 |
(+) |
|
|
|
11 |
0,224 ± 0,16 |
78,24 ± 20,5 |
(++) |
|
|
|
|||||
|
MADUROS |
|
|
|
|
|
|
|
antes cópula |
11 |
0,265 ± 0,04 |
147,33 ± 20,2 |
(+++) |
|
|
después cópula |
15 |
0,259 ± 0,02 |
83,74 ± 14,9 |
(++) |
|
|
|||||
Tabla IV. Modificaciones en volumen del reservorio de las glándulas accesorias dos especies de Canthon (Scarabaeidae: Scarabaeinae) durante los principales períodos comportamentales de la vida imaginal. (*) el cuidado del nido se presenta sólo en Canthon cyanellus cyanellus. (n) número de hembras por grupo (Datos tomados de Martínez, 1994).
|
PERIODOS |
RESERVORIOS GLANDULARES |
||
|
C. indigaceus chevrolati |
C. cyanellus cyanellus |
||
|
PRENIDIFICACIÓN |
|
|
|
|
|
emergencia |
7,1 ± 0,9 (5) |
8,8 ± 0,8 (5) |
|
|
a medio período |
44,4 ± 7,1 (5) |
37,7 ± 8,9 (5) |
|
|
al final del período |
491,0 ± 61,3 (5) |
330,2 ± 27,8 (5) |
|
|
|||
|
NIDIFICACIÓN |
|
|
|
|
|
antes de cópula |
594,1 ± 44,5 (5) |
487,7 ± 52,6 (5) |
|
|
después de cópula |
219,7 ± 35,6 (5) |
278,7 ± 15,4 (5) |
|
|
durante cuidado de nido* |
|
333,1 ± 23,6 (5) |
|
|
|||
|
POSNIDIFICACIÓN |
145,4 ± 45,0 (5) |
145,9 ± 23,4 (5) |
|
|
|
|||
Estas técnicas se han empleado satisfactoriamente en algunas especies de Scarabaeidae para relacionar el estado morfo-fisiológico de los órganos reproductivos solamente, o de los órganos reproductivos y endocrinos, con la etología o con la ecología (Martínez, 1992, 1994, 1995; Martínez & Cruz, 1992, 1998; Martínez et al., 1996, 1998, Cruz & Huerta, 1998). Del mismo modo se han empleado en otras especies de Aphodiidae para establecer la fenología y los ciclos reproductivos (Christensen & Dobson, 1976; Martínez & Cruz, en prensa; Cruz et al., en prensa).
Agradecimiento
In memorian a los Profesores: Jacques Carayon y Claude Caussanel (Museo Nacional de Historia Natural de París, Francia) a quienes debo mi formación en el estudio de la microanatomía y de la fisiología de insectos, respectivamente. Al Dr. Gonzalo Halffter quien desde hace muchos años me ha impulsado a estudiar los insectos. A Magdalena Cruz y Ma. Teresa Suárez L. por la revisión del manuscrito. Este trabajo se llevó a cabo con el apoyo del Departamento de Ecología y Comportamiento Animal del Instituto de Ecología A.C. de Xalapa, México (Cuenta 902-38)
Bibliografía
Alvarado, O. M. 2001. Datos sobre la biología y la reproducción en Aphodius (Trichaphodius opisthius) Bates, 1887 (Coleoptera: Aphodiidae). Tesis de Licenciatura. Universidad Veracruzana. México. 53 pp.
Bonhag, P. F. 1958. Ovarian structure and vitellogenesis in Insects. Annual Review of Entomology, 3: 137-180.
Carayon, J. 1969. Emploi du noir du chlorazol en anatomie microscopique des insectes. Annales de la Société Entomologique de France. (N.S.), 5(1): 179-193.
Chen, P. S. 1984. The functional morphology and biochemistry of insect male accesory glands and their secretion. Annual Review of Entomology, 29: 233-255.
Christensen, C. M. & Dobson, R. C. 1976. Biological and ecological studies on Aphodius distinctus (Mueller) (Coleoptera: Scarabaeidae). The American Midland Naturalist, 95(1): 242-249.
Cruz, R. M. & Huerta, C. C. 1998. Comportamiento y actividad reproductora de los machos de Copris incertus Say (Coleoptera Scarabaeidae: Scarabaeinae). Acta Zoológica Mexicana (n.s.), 74: 163-173.
Cruz, R. M. , Martínez M. I. & M. Alvarado, O. (en prensa). Population and reproductive features of Aphodius (Trichaphodius) opisthius Bates and Cephalocyclus hogei Bates (Coleoptera, Aphodiidae: Aphodiinae). The Coleopterists Bulletin.
Davey, K. G. 1985. The male reproductive tract. In Kerkut, G. A. & Gilbert, L. I. (ed.), Comprehensive Insect physiology, biochemistry and pharmacology. Ed. Pergamon Press. 1: 1-14.
Engelmann, F. 1970. The physiology of Insect reproduction. Ed. Pergamon Press. 307 pp.
Gabe, M. 1968. Techniques histologiques. Masson, Paris. vi+1113 pp.
Langeron, M. 1969. Précis de microscopie. 7ème. édition. Masson et Cie. Paris. 1430 pp.
Mann, T. 1984. Spermathophores development: structure, biochemical attributes and role in the transfer of spermatozoa. Zoophysiology, 15: 1-217.
Martínez, M.I. 1992a. Données comparatives sur l'activité reproductrice chez Canthon indigaceus chevrolati Harold et Canthon cyanellus cyanellus LeConte (Coleoptera, Scarabaeidae). Annales de la Société Entomologique de France (N.S.), 28(4): 397-408.
Martínez, M.I. 1992b. L'activité ovarienne pendant la vie imaginale chez deux espèces de Canthon (Coleoptera, Scarabaeidae). Bolletino del Museo Regionale di Scienze Naturali - Torino, 10(2): 367-386.
Martínez, M. I. 1994. Observations on control of male reproduction in two species of Canthon Hoffmannsegg (Coleoptera Scarabaeidae: Scarabeinae). Elytron, 8: 211-221.
Martínez, M.I. 1995. Observations on reproductive control in females of two species of Canthon Hoffmannsegg (Coleoptera Scarabaeidae: Scarabaeinae). Bolletino del Museo Regionale di Scienze Naturali - Torino, 13 (2): 327-343.
Martínez, M.I. 1999. Estudio de la anatomía microscópica en Insectos. Folia Entomológica Mexicana, 105: 65-76.
Martínez, M.I. & Cruz. R.M. 1992. L'activité de l'appareil reproducteur mâle pendant la vie imaginale chez deux espèces de Canthon (Coleoptera: Scarabaeinae). Acta Zoológica Mexicana, 49: 1-22.
Martínez, M. I. & Cruz, R. M. 1998. Effects of nourishment on the reproductive activity of Canthon cyanellus cyanellus LeConte (Coleoptera, Scarabeidae). The Coleopterists Bulletin, 52(3): 237-243.
Martínez, M. I. & M. Cruz R. (en prensa). Fenología y ciclos reproductivos en Ataenius apicalis Hinton y Ataenius sculptor Harold (Coleoptera Scarabaeoidea Aphodiidae: Eupariinae). Annales de la Société entomologique de France (n.s.).
Martínez, M.I., Hernández Ortiz, V. & Luna, L.R. 1995. Desarrollo y maduración sexual en hembras y machos de Anastrepha serpentina (Wiedemann) (Diptera:Tephritidae). Acta Zoológica Mexicana, 65: 75-88.
Martínez, M.I.& Hernández Ortiz, V. 1997. Anatomy of the reproductive system in six Anastrepha species and comments regarding their terminology in Tephritidae (Diptera). Proceedings of the Entomological Society of Washington, 99(4): 727-743.
Martínez, M.I. & Huerta, C.C. 1997. Coordinated activity of the ovary, pars intercerebralis and corpora allata during the prenesting and nesting cycles of Copris incertus Say (Coleoptera Scarabaeidae: Scarabaeinae). The Coleopterists Bulletin, 51(4): 351-363.
Martínez, M.I., Huerta,C.C.& Cruz, R.M. 1996. Comportamiento reproductor en hembras de Copris incertus Say (Coleoptera Scarabaeidae: Scarabaeinae). Bulletin de la Société Entomologique de France, 101(2): 121-130.
Martínez, M.I. & Montes de Oca T. E. 1994. Observaciones sobre el medio ambiente y el ciclo biológico de dos especies de escarabajos rodadores (Coleoptera Scarabaeidae, Canthon). Folia Entomológica Mexicana, 91: 47-59.
Martínez, M. I., Montes De Oca, T. E. & Cruz, R. M. 1998. Contribución al conocimiento de la biología del escarabajo coprófago Onthophagus incensus Say (Coleoptera Scarabaeidae: Scarabaeinae): datos ecológicos y reproductivos en relación a su fenología. Folia Entomológica Mexicana, 103: 1-13.
Martoja, R. & Martoja, M. 1967. Initiation aux techniques de l’histologie animal. Masson et Cie. Paris. 345 pp.
Morgan, P. B. 1971. A procedure for satining whole mounts of gonads of house flies. Annals of Entomological Society of America, 64(2): 535.
Morón, M. A., Ratcliffe, B. C. & Deloya, C. 1997. Atlas de los escarabajos de México. Coleoptera: Lamellicornia. Vol. I. Familia Melolonthidae. Comisión Nacional para el Conocimiento y uso de la Biodiversidad (CONABIO) y Sociedad Mexicana de Entomología. México. 280 pp.
Pearse, A. G. E. 1968. Histochemistry theoretical and Applied. Vol.1. Little, Brown and Company. Boston. 759 pp.
Wigglesworth, V. B. 1953. The principles of Insect Physiology. London. Methuen & Co. Ltd. 546 pp.
Página creada en mayo de 2002
Última actualización: sábado, 25 de mayo de 2002