|
..... |
Entomología aplicada (VI):
Dípteros
de interés agronómico.
Agromícidos plaga de cultivos hortícolas intensivos
Pablo Barranco Vega
Dpto. Biología Aplicada. Cite II-B.
Universidad de Almería.
04120 Almería
I N D I C E
1.
INTRODUCCIÓN
1.1. Familias formadoras de plagas
Familia TIPULIDAE
Familia BIBIONIDAE
Familia TEPHRITIDAE (Moscas de
las frutas)
Familia SCIARIDAE
Familia ANTHOMYZIDAE
Familia AGROMYZIDAE
1.2.
Familias depredadoras y parasitoides
Familia BOMBYLIIDAE
Familia TACHINIDAE
Familia CECIDOMYIIDAE
Familia SYRPHIDAE
2.
AGROMÍCIDOS
2.1.
Especies plaga del género Liriomyza
2.2. Morfología
2.3. Biología. Desarrollo y ciclo de
vida. Fertilidad
2.4. Ecología. Factores abióticos.
Plantas hospedantes. Enemigos naturales
2.5. Daños
2.6. Métodos de control. Umbrales económicos.
Técnicas de muestreo. Métodos físicos
y agronómicos. Métodos químicos. Métodos
biológicos. Métodos de Lucha Integrada
3.
CONCLUSIONES Y RECOMENDACIONES
4.
BIBLIOGRAFÍA
1.
INTRODUCCIÓN 
En
la actualidad hay descritas unas 125.000 especies de dípteros
vivientes, agrupados en dos subórdenes, 8-10 infraórdenes,
22-32 superfamilias y al menos 130 familias (YEATES y WIEGMANN,
1999). Aunque algunas otras clasificaciones elevan el número
de superfamilias a 36 con 153 familias, e incluso otros autores
consideran la existencia de tres subórdenes. En la
península Ibérica se han citado 115 familias
con 6.433 especies (CARLES-TOLRÁ, 2002).
Algunas de las familias de dípteros revisten especial
interés desde un punto de vista económico por
su interés agrícola, veterinario o médico.
En el sentido agronómico, algunas tienen interés
bien porque comprenden especies que constituyen plagas de
los cultivos (Tipulidae, Bibionidae, Tephritidae,
Anthomyzidae, Agromyzidae y ocasionalmente Sciaridae
y Chloropidae), bien porque forman parte de la
fauna auxiliar que controlan las especies plaga, depredadoras
o parasitoides (Bombilidae, Tachinidae, Cecidomyiidae,
Syrphidae y ocasionalmente Asilidae).

1.1.
Familias formadoras de plagas
Familia
TIPULIDAE
Los
tipúlidos constituyen una gran familia de moscas de
distribución mundial y de forma peculiar. Los adultos
se reconocen por las siguientes características: cuerpo
delgado, de longitud que varía desde unos pocos hasta
los 60 mm. Presentan patas muy largas y delgadas, fácilmente
desprendibles de su cuerpo en la base del fémur. El
tórax tiene una sutura en forma de "V" que
divide el mesonoto en dos. Las alas son angostas con patrones
de coloración variables y una venación también
variable, pero siempre con 2 venas anales. La coloración
del cuerpo es principalmente de tonalidades pardas, aunque
hay especies con colores llamativos. Las larvas presentan
la cutícula unida alrededor de la cabeza, permitiéndole
retraerse y los espiráculos abdominales terminales
rodeados por 5 ó 6 lóbulos carnosos.
Se reconocen tres subfamilias: Cylindrotominae, Limoniinae
y Tipulinae con más de 15.000 especies descritas
de tipúlidos en el mundo. En la península Ibérica
se conocen 143 especies (CARLES-TOLRÁ, 2002).
Los adultos de Tipulidae pueden ser encontrados en hábitats
variados: a lo largo de corrientes de agua, en bosques nubosos,
en ciénagas y aún en desiertos, pero generalmente
cerca del hábitat de las larvas. Las larvas pueden
encontrarse en una gran variedad de hábitats acuáticos
o terrestres y son comunes en los sedimentos o entre las hojas
del fondo de corrientes o escurrideros, troncos podridos y
otra materia vegetal en descomposición, hongos, musgos
y suelo del bosque. Unas pocas especies pueden causar daño
económico a cultivos agrícolas. Sólo
en un porcentaje muy pequeño de las especies (<5%)
se ha conseguido asociar las larvas con sus respectivos adultos
y los estados inmaduros de muchos géneros aún
no se han descubierto.

Familia BIBIONIDAE
HLos
Bibiónidos corresponden a un grupo de moscas comúnmente
negras, con un tamaño que varía de 4,5 a 7,0
mm. A pesar de que el grupo es claramente monofilético,
hay considerable variación de forma entre sus miembros.
Los machos son siempre holópticos.
Las antenas son cortas en todos los géneros excepto
Hesperinus y presentan a lo más 10, en algunos
casos 7 ó aún 5 flagelómeros cortos.
Los palpos maxilares siempre son de 5 segmentos. Los ocelos
están presentes. El tórax en Hesperinus
se asemeja al de los Anisopodidae, pero algunos géneros
presentan fuertes alteraciones, tales como hileras de espinas
y un pronoto proyectado como en las especies del género
Dilophus, o largos grupos de setas.
Las patas son alargadas en las especies de Hesperinus,
pero son cortas en el resto de géneros. Las tibias
anteriores presentan un fuerte mucrón en las especies
de la tribu Bibionini o un anillo de espinas fuertes
en las especies del género Dilophus. Las alas nunca
presentan la vena M3. La vena R4+5 puede ser bifurcada o simple,
pero la R2+3 está siempre ausente. Sólo 8 géneros
se reconocen en Bibionidae con más de 700 especies
descritas para el mundo. En la península Ibérica
se han citado 22 especies (CARLES-TOLRÁ, 2002).
Los Bibiónidos, al igual que otros Bibionomorpha,
se les encuentra principalmente sobre madera en descomposición,
suelo rico en humus, y en raíces. En algunos casos,
pueden causar daños a plantas cultivadas. Los adultos
de algunas especies emergen y vuelan en grandes grupos.

Familia
TEPHRITIDAE (Moscas de las frutas)
Los
tefrítidos o verdaderas moscas de las frutas incluyen
algunas especies ecológicamente interesantes y económicamente
importantes. Los adultos generalmente no producen daño,
pero las larvas, que se alimentan de tejido vegetal vivo,
causan daños serios a muchas frutas comerciales. Entre
las principales plagas agrícolas se incluyen la mosca
del Mediterráneo Ceratitis capitata (Wied.)
y Bactrocera oleae (Gmelin).
Los Tephritidae se reconocen fundamentalmente por la
vena subcostal, que se dirige bruscamente hacia delante. Sus
alas irregularmente manchadas en variados patrones según
la especie y su ovipositor bien esclerotizado en las hembras
las distinguen de casi todas las otras familias, excepto de
algunas estrechamente relacionadas. Casi 5.000 especies se
conocen en todo el mundo, en la península Ibérica
hay 113 especies (CARLES-TOLRÁ, 2002)..
Esta familia se puede dividir taxonómica en tres grupos:
las subfamilias Tephritinae, Dacinae y Trypetinae.
Los tefrítidos presentan varios comportamientos y formas
interesantes. En algunas especies del género Rhagoletis
las alas son colocadas de tal forma que sus dibujos se asemejan
a una araña saltadora, probablemente para ahuyentar
a sus depredadores. Otras especies son imitadores de avispas.
El cortejo frecuentemente incluye ondulación de las
alas y producción de feromonas por los machos. Estos
en algunas especies tienden a formar grupos mientras liberan
la feromona de atracción para las hembras. Algunas
hembras de Trypetinae producen una feromona de oviposición,
con el fin de evitar que otras hembras depositen huevos en
el mismo fruto. De modo que se pueden emplear trampas especializadas
de atrayentes alimenticios para algunas especies plaga.

Familia
SCIARIDAE
Los
Sciaridae son una familia amplia de moscas, cuyo tamaño
varía entre 1,0 y 11,0 mm. Las especies de la mayoría
de los géneros presentan puente ocular y antenas largas
con flagelómeros cilíndricos y cubiertos de
setas. Los palpos maxilares presentan de 1 a 4 palpómeros;
cuando se presenta más de un segmento, el basal es
muy reducido y el segundo por lo general tiene un foso sensorial.
Están presentes 3 ocelos.
Algunos de los escleritos pleurales presentan vellosidad,
particularmente el pronoto y el proepisterno y generalmente
poseen un foso pleural evidente. Las alas son muy típicas,
principalmente debido a la posición longitudinal de
las venas r-m y m-cu, la vena R5 nunca bifurcada, paralela
a C en la mayor parte de su longitud (las R2+3 y R4 siempre
están ausentes), la ausencia de M3 y la celda discal
y la posición basal de la bifurcación de CuA.
Las hembras son generalmente más grandes que los machos
y la terminalia del macho es muy constante en toda la familia.
Se conocen alrededor de 100 géneros de esciáridos
y posiblemente más de 1.000 especies han sido descritas
en el mundo. Esta familia no está recogida en el catálogo
de los dípteros ibéricos. En términos
generales las larvas se alimentan de hongos. Pueden ser recolectados
en casi cualquier lugar húmedo con materia vegetal
en descomposición atacada por hongos. Diferentes grupos
de la familia están especializados en atacar tejidos
vivos de plantas. Se han citado atacando plantaciones de hongos
comestibles, así como de daños en Eucalyptus,
varias especies de Solanum y plantaciones de rosas.
El hábito de las larvas de pupar juntas es un patrón
general en la familia, aunque se ha perdido en algunos subgrupos.

Familia
ANTHOMYZIDAE
Estas
pequeñas moscas son alargadas, delgadas y algo aplanadas.
Características morfológicas detalladas incluyen
una arista antenal con pelos largos o cortos y algunas veces
plumosa. Con vibrisas orales fuertes.
Los ojos están en contacto sobre el vertex. Hay de
1 a 3 pares de setas sobre la parte superior de la cabeza,
que se dirigen hacia el centro y/o hacia atrás. Las
alas son largas y delgadas, transparentes o con manchas difusas
café claro, particularmente en el ápice del
ala y/o con manchas blanquecinas, y con un reducido lóbulo
anal.
El patrón de coloración varía tremendamente,
desde casi completamente amarilla a totalmente negra, generalmente
con patrones de ambos colores en el cuerpo. Lo más
común es que tengan la parte dorsal del cuerpo negra
y el resto amarilla. En la península Ibérica
tan sólo se conocen 6 especies (CARLES-TOLRÁ,
2002).
Las especies de esta familia están asociadas con los
bosques. Algunas especies son colectadas en flores y otras
son enrolladoras de hojas. Se capturan con frecuencia con
trampas "Malaise".

Familia
AGROMYZIDAE

Esta
familia es el objeto de este artículo y se comenta
en profundidad más adelante.

1.2.
Familias depredadoras y parasitoides

Familia
BOMBYLIIDAE

Los
Bombyliidae o bombílidos se encuentran en todo el mundo,
especialmente en áreas secas o desérticas. Muestran
una variedad extrema de formas y tamaños, desde 1mm
hasta más de 50 mm de envergadura.
Muchas especies tropicales son de colores oscuros con un cuerpo
finamente peludo, dándoles la apariencia de abejas.
Algunas especies del género Systropus son excelentes
imitadores de avispas. Las alas son generalmente transparentes,
pero muchas poseen en ellas manchas o patrones complejos de
color oscuro.
Los bombílidos se caracterizan por la presencia de
sólo cuatro o menos celdas posteriores en el ala y
una celda anal bien formada. Hay más de 5000 especies
de bombílidos en el mundo, en más de 200 géneros.
En la península Ibérica existen 199 especies
(CARLES-TOLRÁ, 2002).
Los adultos se encuentran comúnmente entre las flores
alimentándose de néctar y polen o se posan al
sol sobre rocas descubiertas, ramas y senderos. Las larvas
se localizan raramente, pero todas ellas se conocen como parasitoides
o depredadoras de una gran variedad de ordenes de insectos,
desde ortópteros hasta himenópteros.

Familia
TACHINIDAE 
Los
taquínidos adultos varían en tamaño desde
los 2 a los 20 mm de longitud. A pesar de que casi todos son
de forma similar a la mosca común, unos pocos son delgados
y con forma de avispa y los miembros del género Trichopoda
asemejan abejas meliponinas.
Se encuentran en todos los hábitats y a cualquier cota;
casi todos son activos sólo en las horas soleadas del
día pero unos pocos son de hábitos crepusculares
o nocturnos. Generalmente son muy activos y rápidos,
no permanecen en reposo por más de unos pocos segundos,
y por lo tanto son difíciles de colectar. Muchas especies,
principalmente las más grandes son de cuerpo duro y
muy peludas y frecuentemente de colores vistosos (el abdomen
puede ser anaranjado, azul, ocre o amarillo con el extremo
final negro). En la península Ibérica se conocen
508 especies de esta familia (CARLES-TOLRÁ, 2002).
Las larvas de todos los Tachinidae cuyos hábitos
se conocen son parasitoides internos de otros insectos (además
de algunas arañas y ciempiés). Al comienzo de
su desarrollo son verdaderos parásitos, consumiendo
los cuerpos grasos sin producir daños serios a su hospedante.
Sólo en el último estadio, las larvas destruyen
a su hospedador, a pesar de que hay unas pocas especies que
no lo hacen y el hospedante puede sobrevivir y completar su
desarrollo. La gran mayoría de los hospedantes de los
taquínidos son orugas de Lepidópteros. Las hembras
de algunas especies escogen a su hospedador y depositan un
huevo directamente sobre él. Pero la mayoría
de los taquínidos no necesita encontrar directamente
un hospedante para parasitarlo.
Los Tachinidae de setas largas depositan huevos a punto
de eclosionar sobre plantas apropiadas; las larvas que salen
de estos huevos esperan a que un hospedador apropiado pase
para sujetarse a él, penetrarlo y completar su desarrollo.
Otras especies, ponen huevos diminutos con un corión
muy duro que son adheridos al follaje. Cuando éste
es comido por el hospedante correcto, los huevos eclosionan
y las pequeñas larvas perforan el tracto digestivo
para completar su desarrollo dentro de la cavidad corporal.
Un tercer grupo de especies dispersan sus huevos en el suelo
o sobre troncos podridos donde existe la posibilidad de que
hayan larvas de Scarabaeidae o Cerambycidae
que serán localizados por las larvas neonatas. No obstante
una especie parasita de lepidópteros (Exorista sorbillans)
muy útil en lucha biológica contra plagas de
este orden, es a su vez una plaga para el gusano de seda,
llegando a producir pérdidas de hasta un 30% en las
producciones serícolas (KUMAR et al., 1993).
La pupación ocurre en el suelo dentro del pupario formado
por la cutícula del último estadio larvario.
Allí están relativamente protegidos de hormigas
y otros depredadores. Sin embargo no pueden resistir ataques
de himenópteros parasíticos.
Familia
CECIDOMYIIDAE 
Los
cecidómidos o mosquitos de las agallas, son moscas
finas y frágiles, de aproximadamente 3 mm de longitud.
Las antenas son por lo general largas y flexibles, principalmente
en los machos. La venación de las alas es muy reducida
mostrando sólo dos venas largas y notorias. La tibia
carece de espinas. El color es variable, algunas veces con
patrones llamativos claros y oscuros. Alrededor de 4700 especies
se conocen del mundo. En la península Ibérica
se han citado 260 especies (CARLES-TOLRÁ, 2002).
Los adultos de estos mosquitos son colectados en gran número
en trampas de luz y de intercepción, pero la mejor
forma para estudiar los mosquitos de agallas es encontrando
las agallas que ellos producen en algunas plantas. De esta
forma, pueden ser asociados ambos sexos, que generalmente
presentan formas muy diferentes y también se pueden
asociar los adultos con sus larvas y pupas, las cuales por
sus características generalmente son más apropiadas
para diferenciar especies.
El conocer los hospedadores proporciona una nueva dimensión
del estudio de estos insectos. Las agallas de los cecidómidos
pueden ser encontradas en casi todos los grupos de plantas.
No todos los cecidómidos se alimentan de plantas: las
especies más primitivas se alimentan de materia orgánica
en descomposición y muchos otros son depredadores de
ácaros, áfidos, cóccidos y otros artrópodos,
o viven en asociación con ciertos hongos.

Familia
SYRPHIDAE 
Los
adultos de Syrphidae, comúnmente llamados moscas
de las flores, son moscas bastante llamativas. Su longitud
varía desde los 4 mm hasta más de 25 mm y su
coloración va desde amarillo o anaranjado brillante,
hasta negro o grises oscuros y opacos, existiendo algunas
especies de colores iridiscentes. Los Syrphidae son
abundantes casi en cualquier parte, excepto en las zonas áridas
del Viejo Mundo y en la región Antártica. En
el Mundo se conocen unas 5400 especies en tres subfamilias,
Microdontinae, Syrphinae y Eristaliinae.
En la península Ibérica se conocen 348 especies
(CARLES-TOLRÁ, 2002).
Muchos sírfidos son imitadores de himenópteros
de aguijón (avispas y otros). Se distinguen fácilmente
de las otras moscas por poseer una muy particular combinación
de características en la venación de las alas:
una celda apical (r4+5) y una celda anal grande, de 1/3 ó
más del largo del ala que es única de los sírfidos.
Las moscas de las flores, como su nombre indica, usan aquellas
como sitios de apareamiento y fuentes de néctar y polen
para alimento. Sólo a los miembros de una subfamilia
(Microdontinae) no se les encuentra asociados con flores,
sino con sus hormigas hospedadoras. Las larvas aparecen en
una gran variedad de hábitats. Las larvas de la subfamilia
Microdontinae viven dentro de nidos de hormigas. Las
de Syrphinae son depredadoras de artrópodos
de cuerpo blando. Sin embargo, ocasionalmente algunas pueden
ser carroñeras. Las de Eristalinae pueden ser
depredadoras o alimentarse de materia en descomposición
(saprófagas) en el mantillo o madera en descomposición,
de excrementos (coprófagas), de hongos (micetófagas),
de plantas donde perforan tallos y minan hojas (fitófagas)
o pueden ser filtradoras acuáticas o inquilinas especializadas
en nidos de insectos sociales (termitas, avispas y abejas).
Las moscas de las flores son de gran importancia económica.
Los adultos son polinizadores de gran relevancia y pueden
desempeñar el papel de las abejas. Las larvas de la
subfamilia Syrphinae son depredadores muy importantes
de muchas plagas tales como áfidos, cóccidos,
trips y larvas de mariposas, y son sólo comparables
con los coccinélidos y crisópidos como depredadores
de importancia para el control biológico. Sin embargo,
algunos sírfidos son perjudiciales. Las larvas de algunas
especies de los géneros Merodon y Eumerus
atacan bulbos y tubérculos de plantas ornamentales
y legumbres. Incluso, algunas especies han sido citadas como
causantes de miasis accidental en humanos.

2.
AGROMÍCIDOS 
Los
Agromyzidae son conocidos fundamentalmente como minadores
de hoja, si bien sólo el 75% de las 1.800 especies
conocidas se nutren de este modo, alimentándose las
larvas de otras especies de diferentes partes de la planta.
De hecho las especies que constituyen plagas se alimentan
de formas muy diversas.
Tal y como recoge SPENCER (1973) en su recopilación
de tratados antiguos sobre el grupo, los minadores de hoja
se citan por primera vez por Beckmann en 1681 sobre cerezos
en Alemania. Aunque en aquella época se pensaba que
estas galerías se debían a pequeñas serpientes
que descendían desde el cielo o que emanaban del aire
putrefacto o ciénagas. No obstante este autor demostró
que estas galerías estaban producidas por insectos.
Pero no fue hasta 1737 que Réamur cita un díptero
agromícido como minador de hojas, y posteriormente
Curtis en 1844-46 señala por primera vez daños
en plantas ornamentales de esta familia de dípteros.
Los primeros daños de esta familia en cultivos fueron
señalados por Rondani en 1875, que cita la especie
Liriomyza cicerina (Rond.) sobre Cicer arietinum
L. (garbanzo). Durante la segunda mitad del siglo XIX y comienzos
del XX se han ido sucediendo las citas de daños de
agromícidos en cultivos, igualmente de SPENCER (1973).
El grado de daño causado por los agromícidos
en las plantas depende en primer lugar del tamaño de
la población, del modo de alimentación de la
larva, de la parte de la planta a la que ataque y su estado
de crecimiento. Las especies que aparecen en un elevado número
en estado de larva coincidiendo con el periodo de siembra
de un cultivo, pueden convertirse en una plaga con efectos
muy severos.
En condiciones normales, la mayoría de las especies
están bien controladas por sus propios parasitoides,
de modo que aparecen en los cultivos pero a niveles bajos
que no revisten interés económico. Esta situación
se interrumpe periódicamente por causas naturales,
como la desincronización entre la aparición
de la plaga y sus parasitoides, o bien que éstos se
vean diezmados por causas climáticas, lo que produce
un incremento de la población del huésped. Estas
explosiones poblacionales de la plaga no suelen durar más
de dos años y después de transcurrido este periodo,
el nivel de individuos suele volver a su escasa tasa de incidencia
controlado por los parasitoides.
Sin embargo, en la actualidad en determinadas zonas, se presenta
una situación mucho más grave debido a la presión
de insecticidas a la que están sometidos algunos cultivos,
que ha interrumpido el control natural de los parasitoides
sobre los minadores, de modo que algunas especies de minadores
que no se consideraban plaga antes de la aparición
de los insecticidas, ahora si lo son, como es el caso de Liriomyza
sativae Blanchard después del uso del DDT. A partir
de los años cincuenta se generaliza la aparición
de cultivos afectados por poblaciones elevadas de minadores,
tanto en América del Norte, Sur, Europa y Asia. De
modo que ya se han documentado casos de resistencias de minadores
a determinadas materias activas de uso corriente (ver más
adelante).
Aunque el principal daño de los Agromícidos
es debido a las larvas, también las hembras pueden
producir daños importantes debidos a sus hábitos
alimenticios y de oviposición. Éstas practican
pequeñas punteaduras en las hojas y pétalos
de flores, de modo que si la densidad de hembras es muy elevada
pueden llegar a producir la destrucción de estas estructuras.
Las especies más primitivas de Agromícidos son
taladros de leñosas, raíces o tallos de herbáceas.
Especialmente importantes son algunas especies que afectan
a tubérculos como Liriomyza braziliensis (Frost)
que ataca las patatas en Sudamérica y Napomyza carotae
Spencer que afecta a la zanahoria en Centroeuropa. Por último,
otros minadores se alimentan de las vainas y semillas de algunas
leguminosas como algunas especies del género Melanagromyza
que ataca a los cultivos de judías (caupí) en
el sudeste asiático y (frijoles) en África.
El daño de los minadores de hoja, dependiendo de la
severidad del ataque, produce una disminución de la
capacidad fotosintética de la planta, propicia la desecación
de las hojas y su caída prematura; con lo que en cultivos
jóvenes con un fuerte ataque puede llegar a perderse
la planta completa. Las especies de minadores más agresivas
se encuadran en el género Liriomyza que incluye
especies muy polífagas y ampliamente distribuidas,
como L. huidobrensis, L. sativae, L. bryoniae,
L. cepae, etc. Algunas especies producen daños
en cereales, con poblaciones muy numerosas, si bien sus daños
no suelen ser muy importantes (SPENCER, 1973).
Paralelamente, los daños producidos por Agromícidos
pueden propiciar daños secundarios por infecciones
fúngicas.
Por el contrario, algunas especies de minadores se utilizan
para luchar contra malas hierbas invasoras en algunas regiones,
como Chomolaena odorata (L.) (Asteracea) en
Sudáfrica (ZACHARIADES et al., 1999).
La sistemática de los Agromícidos ha sido revisada
y discutida en numerosos libros y artículos desde los
años treinta.
La evolución de los dípteros agromícidos
está relacionada con la de las plantas Angiospermas.
De hecho, no se conoce ningún fósil de esta
familia, aunque sí de otras afines en ámbar
del Báltico. La mayoría de los géneros
de Agromícidos tiene su propio patrón de alimentación
lo que denota su alto grado de evolución y la vinculación
con la evolución de las Angiospermas. Las especies
más primitivas son las perforadoras de madera de troncos
y tallos, y las más evolucionadas las minadoras de
hojas. La especificidad huésped-parásito se
establece en los adultos, puesto que larvas transplantadas
se desarrollan y llegan a imago. Sin embargo, los adultos
han desarrollado sistemas de detección e identificación
de determinadas plantas mediante el olor y el sabor, con el
que seleccionan su huésped.
Muchas de las especies de interés agronómico
se identifican por la relación entre el hospedante
y los estados inmaduros de la plaga. Si bien en algunos casos
es necesario recurrir a la genitalia masculina, e incluso
otras técnicas como la electroforesis (MENKEN y ULENBERG,
1983; ZEHNDER et al., 1983). Igualmente, en la actualidad
se están realizando estudios genéticos que clarifican
la situación de determinados taxones (MORGAN et al.,
2000), o evidencian la existencia de dos especies en las poblaciones
en las siempre se ha considerado únicamente L. huidobrensis
(SCHEFFER, 2000).
La familia Agromyzidae se subdivide en dos subfamilias:
Agromyzinae y Phytomyzinae, que se diferencian
en la morfología de la vena subcosta (la subcosta converge
en la R1 en Agromyzinae y en la vena costa en Phytomyzinae).
Posee 25 géneros, de los cuales 16 tienen interés
agronómico por contener especies plaga. De éstos,
los más importantes son Liriomyza Mik con 23
(Agromyzinae), Agromyza Fallén con 28 especies
plaga y Melanagromyza Hendel con 20 (ambos Phytomyzinae).
Los dos primeros géneros están representados
en Europa por numerosas especies, mientras que el último
presenta únicamente una especie en el Reino Unido.
En la península Ibérica se han citado 20 géneros
con 212 especies, de las cuales 28 se han descrito de material
peninsular (CARLES-TOLRÁ, 2002).

2.1.
Especies plaga del género Liriomyza 
El
género Liriomyza presenta, en la actualidad, 13 especies
en Europa que producen daños fundamentalmente en las
hojas de Crucíferas, Liliáceas, Leguminosas
y Gramíneas: L. brassicae (Riley), L. bryoniae
(Kalt.), L. cepae (Hg.), L. cicerina (Rond.),
L. congesta (Besck.), L. crucifericola (Hg.),
L. flaveola (Fall.), L. huidobrensis (Blanchard),
L. nietzkei Sp., L. pisivola Hg., L. strigata
(Mg.), L. trifolii (Burguess) y L. urophorina
Mik. Si bien una nueva especie americana ha sido recientemente
encontrada en Francia: se trata de L. sativae Blanchard
procedente de material infestado de Israel, y es precisamente
una especie plaga de cuarentena EPPO (EPPO, 2000).
La mayoría de las especies de agromícidos muestran
un alto nivel de especificidad del huésped, restringen
sus hospedantes a un género o una familia. Si bien
algunas especies se comportan como polífagas, lo que
las hace muy relevantes cuando son especies plaga.
Las especies de minadores de hoja polífagas que pueden
encontrarse en los cultivos hortícolas de Europa, al
igual que en España son: L. bryoniae (Kaltenbach,
1858), L. huidobrensis (Blanchard, 1926), L. strigata
(Meigen, 1830) y L. trifolii (Burguess, 1880) (MALAIS
y RAVENSBERG, 1991; SÁNCHEZ, 1994; PASCUAL et al.,
1992).

2.1.1.
Distribución en la península Ibérica

La
distribución original de las cuatro especies presentes
en España ha variado considerablemente con la colonización
de las especies exóticas de nuevas áreas geográficas.
Siempre ligada al tráfico de material infestado desde
los países de origen hacia otros libres inicialmente
de la plaga.
El comportamiento de las nuevas plagas que se introducen en
una nueva área geográfica, suele ser inicialmente
de instalación, seguido de un rápido periodo
de expansión, durante el cual produce infestaciones
muy severas en los cultivos, desplazando a otros congéneres
que existían previamente, bien autóctonos, bien
importados con anterioridad. Posteriormente suele producirse
un declive de la especie en cuestión que suele conducir
al asentamiento definitivo de ésta o a su desaparición.
Las cuatros especies poseen inicialmente un origen geográficamente
muy distante. Por un lado dos especies son de origen paleártico:
L. bryoniae y L. strigata, y las otras dos de
origen neártico: L. trifolii y L. huidobrensis.
L. bryoniae está bien distribuida por el continente
europeo, desde Albania a la Península Ibérica
y Gran Bretaña, también se distribuye por el
norte de África desde Marruecos a Egipto.
L. strigata es frecuente en toda Europa occidental,
mientras que su presencia en la parte oriental no está
documentada (SPENCER, 1973). Se ha extendido en el continente
americano donde está citada en el sur de California
y Florida, Cuba, Jamaica, Venezuela, Perú, Argentina,
Hawaii y Tahití.
L. trifolii se extendió, mediante esquejes de
crisantemo, desde Florida por varias regiones tropicales y
subtropicales de América y África, alcanzando
Europa en 1975-76, pasando por Kenia y Malta, donde fueron
multiplicados los esquejes importados de Florida. Estas plantas
también fueron importadas por varios países
europeos (Alemania, Dinamarca, Gran Bretaña y los Países
Bajos) (BARTLETT y POWELL, 1981; POWELL, 1981). Desde éstos,
por medio de plantas infestadas pasa a Francia: sobre crisantemos
en 1978 (VILLEVIEILLE, 1986); Finlandia, etc. (SPENCER, 1973,
MINKENBERG, 1988a y SÁNCHEZ, 1994). Igualmente, a mediados
de los años setenta es detectada en las Islas Canarias.
En la Península se cita en 1982 por toda la franja
costera de Cataluña, Levante y Andalucía (SÁNCHEZ,
1986). MINKENBERG (1988a) recoge la paulatina colonización
de esta especie por 68 países de todos los continentes.
L. huidobrensis está citada en Argentina, Chile,
Perú, Colombia, Brasil, Venezuela y Estados Unidos.
En Europa se detecta por primera vez en Gran Bretaña
en guisantes importados de Estados Unidos y sobre crisantemos
procedentes de Perú y Colombia. También ha sido
citada en otros países europeos como Francia, Holanda,
Dinamarca, Italia y Portugal; y Oriente Próximo: Líbano
(HAMMAD y NEMER, 2000). En España se localiza por primera
vez en 1992 (CABELLO y BELDA, 1992; PASCUAL et al., 1992).

2.2.
Morfología 
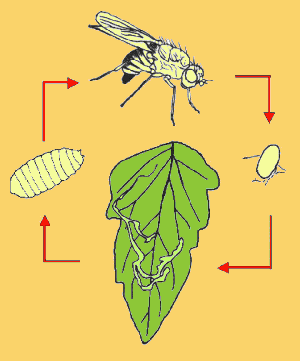
Como
en todos los dípteros, el desarrollo es holometábolo,
con unas larvas muy especializadas a vivir en galerías
(Fig. 1).
 ...
...
2.2.1.
Huevo 
Los
huevos son de forma ligeramente arriñonada, de 0,25
mm de longitud y 0,1 mm de anchura (SÁNCHEZ, 1994),
aunque pueden oscilar entre 0,2-0,27 de largo por 0,12-0,14
de ancho (PEÑA, 1986). Son de color blanco opaco que
cambia con el desarrollo del embrión a blanco transparente,
con la superficie lisa y brillante. Estos huevos son insertados
dentro del tejido de la hoja por la hembra, que practica un
orificio con el ovopositor.

2.2.2.
Larva 
La
larva se desarrolla dentro de la hoja pasando por tres estadios
larvarios. Es de forma cilíndrica, alargada, ápoda
y acéfala, sin segmentación visible. Alcanza
una longitud que varía desde los 0,5 mm que poseen
las larvas neonatas hasta 3,25 mm máximo que presentan
las larvas de L. bryoniae en el tercer estadio (SPENCER,
1973); y 0,3-0,6 de diámetro (SÁNCHEZ, 1986,
1994).
Las piezas bucales están formadas por un par de ganchos
fuertemente aserrados. Presenta espiráculos posteriores
formados de 3 a 12 microporos, según la especie de
que se trate. La coloración de la larva es amarillenta
para L. trifolii y verdosa para el resto de las especies.
El período de prepupa normalmente se produce en el
suelo, pero también en la superficie de la hoja, tanto
en el haz como en el envés (SÁNCHEZ, 1986).

2.2.3.
Pupa 
Tiene
forma de tonel, es de color amarillento a marrón rojizo.
La longitud varía de 1,5-2,3 mm de largo por 0,5-0,8
de ancho. La cutícula del pupario está fuertemente
quitinizada y segmentada. Las características del suelo
donde se desarrolla la pupa no influyen en la mortalidad ni
duración de este estado (OETTING, 1983).
La pupa se realiza en la hoja para L. huidobrensis,
el resto pupa generalmente en el suelo (EPPO, 1984), salvo
en plantas con hojas con muchos tricomas, como la judía,
y entonces pupa sobre ella.

2.2.4.
Adulto 
Son
pequeñas moscas de 1,4 a 2,3 mm de longitud, de coloración
predominantemente amarillenta con manchas negras, con los
ojos rojos o bermellón. La coloración de determinadas
partes del cuerpo como la zona supraorbital, el pronoto o
diferentes porciones de las patas tiene interés taxonómico
y permite agrupar algunas especies.
Sin embargo, el carácter determinante para separarlas,
es la genitalia masculina. De modo que L. trifolii
carece de esclerito en el cuello del distifalo del aedeago,
mientras que en las otras tres especies si existe, siendo
único en L. strigata y doble en L. bryoniae
y L. huidobrensis, si bien en esta última los
lóbulos del distifalo están separados por una
excrecencia.
Igualmente la caperuza aedeagal posee una forma característica
que sirve para diferenciar las especies. Paralelamente se
ha utilizado la electroforesis basada en la movilidad de enzimas,
como método para separar especies (MENKEN y ULENBERG,
1983; ZEHNDER et al., 1983).
La hembra es de mayor tamaño y más robusta que
el macho, apreciándose en la parte final del abdomen
el ovipositor de forma troncocónica y de color negro.

2.3.
Biología 
2.3.1. Desarrollo y ciclo de vida
La
relación entre sexos determinada mediante cría
en laboratorio es de 1. Antes de la cópula tiene lugar
un pequeño baile rítmico de flexión de
las patas y agitación de las alas. Generalmente una
única cópula (que tiene una duración
que oscila entre 6-31 minutos) es suficiente para la puesta
de todos los huevos. Las hembras vírgenes no tienen
capacidad de ovipositar, aunque si ocasionan daños.
Habitualmente las puestas son depositadas en el haz, aunque
en ocasiones también en el envés. La hembra
realiza pequeñas perforaciones con su ovipositor y
deposita un huevo en el parénquima de la hoja, suele
ser en el haz en L. brioniae. L. strigata suele
depositarlo en el envés y cerca del borde y cuando
la larva llega al nervio central de la hoja se traslada al
haz. La larva crece rápidamente y si ha eclosionado
en una hoja demasiado pequeña es capaz de cambiar de
hoja por el peciolo para seguir alimentándose; pero
sin salir nunca de la epidermis de la hoja pues es incapaz
de volver a introducirse (SPENCER, 1973). L. huidobrensis
pone los huevos preferentemente en el envés de la hoja.
En la selección de las plantas y hojas es determinante
la presencia de tricomas, edad de las hojas y turgencia. Las
hembras prefieren hojas con pocos tricomas y hojas desarrolladas
pero jóvenes. De hecho algunas veces los adultos quedan
atrapados entre los tricomas de las hojas y desechan las muy
jóvenes de determinados cultivos por su enorme pilosidad,
que desaparece al desarrollarse la hoja, también descartan
las hojas marchitas (FAGOONEE y TOORY, 1983). No obstante
en los cultivos en invernadero de Almería, plantas
como la judía y sandía con gran cantidad de
tricomas son muy apetecidas y afectadas por los minadores
(CABELLO et al., 1994).
La duración de los diferentes estados varía
dependiendo de la planta hospedadora, fundamentalmente en
el estado de larva (ZOEBISCH y SCHUSTER, 1987b; HAMMAD y NEMER,
2000).
Por lo general, la duración del estado de huevo es
de 4-8 días a temperatura ambiente; el de la larva
9 días, aunque puede oscilar entre 7 y 13. Antes de
pupar la larva realiza una incisión semicircular característica
en la epidermis foliar, posteriormente se deja caer al suelo
donde pupa a muy escasa profundidad, aunque en ocasiones la
pupa aparece adherida a la superficie de la hoja, (cuando
son muy tomentosas). Antes de transformarse en pupa, la larva
permanece 6 horas en periodo de prepupa, bien en la superficie
de la hoja, bien en el suelo. La duración del estado
de pupa varía según la estación, así
las pupas de primavera y verano tardan tres semanas en emerger,
mientras que en invierno ésta se prolonga durante 5-9
semanas. Una vez completado el desarrollo de pupa, el minador
ejerce presión sobre el pupario hasta romperlo; emerge
el adulto que una hora después está completamente
esclerotizado y con la coloración definitiva.
En la tabla I se recoge la duración
de los diferentes estados y estadios de las especies más
importantes en función de la temperatura.

2.3.2.
Fertilidad 
El
número de huevos que puede poner una hembra alcanza
los 163 en L. bryoniae, con un promedio de 7 diarios
aunque esta cantidad puede llegar hasta los 15 diarios. Las
hembras de L. trifolii pueden llegar a poner 389 huevos
con una frecuencia de 19 huevos/día (PARRELLA, 1983);
y L. huidobrensis pone unos 131 huevos en total.
La fecundidad está muy relacionada con la temperatura
y la alimentación, de modo que el número de
huevos/día puestos por la hembra aumenta con la temperatura
(ZOEBISCH et al., 1993). La máxima oviposición
se alcanza a los 30 °C de 100 a 200 huevos, dependiendo
de la planta en la que se realice la puesta. La alimentación
también determina el número de huevos, así
una fuente de carbohidratos como el néctar o la melaza
de los pulgones es capaz de posibilitar la duplicación
en el número de huevos (ZOEBISCH y SCHUSTER, 1987a;
PEÑA, 1986; MALAIS y RAVENSBERG, 1991). La larvas que
han crecido en un tipo u otro de planta también producen
hembras con fertilidad muy diferente (ZOEBISCH y SCHUSTER,
1987b).
La temperatura y el huésped influyen en la fecundidad
(Tabla II). También influye
la luminosidad, puesto que sin suficiente luz las moscas no
son activas. La humedad relativa también influye en
la fecundidad, desarrollo de los huevos y longevidad de las
hembras (SÁNCHEZ, 1991). Una humedad relativa del orden
del 80-90% estimula la puesta (MALAIS y RAVENSBERG, 1991).
Por otro lado, cuanto mayor es el tamaño de la pupa,
la hembra tiene mayor tamaño y pone un número
elevado de huevos. Lo cual depende, a su vez, de la densidad
intraespecífica, cuanto menor es la competencia entre
individuos, las hembras adquieren mayor tamaño y la
fecundidad aumenta (PARRELLA, 1983)
Tiene forma de tonel, es de color amarillento a marrón
rojizo. La longitud varía de 1,5-2,3 mm de largo por
0,5-0,8 de ancho. La cutícula del pupario está
fuertemente quitinizada y segmentada. Las características
del suelo donde se desarrolla la pupa no influyen en la mortalidad
ni duración de este estado (OETTING, 1983).

2.4.
Ecología 
TLas
especies de minadores autóctonas no causaban daños
muy severos en cultivos hortícolas en invernaderos
de Andalucía; sin embargo, la situación cambió
drásticamente con la introducción en España
en 1982 del minador americano L. trifolii, que llegó
a constituir una plaga de gran severidad, desplazando a la
especie autóctona L. bryoniae (CABELLO et al.,
1990). Posteriormente, la introducción en 1991 del
minador suramericano L. huidobrensis, (CABELLO y BELDA,
1992), desplazó a la especie anterior y volvieron a
producirse graves daños en la campaña 1992/93.
L. trifolii tiene un comportamiento estereotipado de
perforación, alimentación y oviposición
independientemente del hospedante, si bien el tiempo de alimentación
puede ser muy breve si la planta no es totalmente de su agrado,
ya que detecta rápidamente sustancias repelentes (BETHKE
y PARRELLA, 1985). Se ha constatado que los machos no se alimentan
en las picaduras que producen las hembras, sino de otras fuentes
como el néctar y la melaza de los pulgones, el aporte
de está última sustancia produce un aumento
en la longevidad y fecundidad de las hembras, por lo que ha
de evitarse su presencia en los cultivos y malas hierbas (ZOEBISCH
y SCHUSTER, 1987a).
Las hembras de minador son capaces de seleccionar hojas sanas
y desechar las que estén afectadas por otras plagas,
como mosca blanca por ejemplo (INBAR et al., 1999).
El número de grados/día varía dependiendo
de las condiciones de desarrollo: tanto temperatura como cultivo.
Para L. trifolii, es de 85 GDA y de 80,7 GDA en condiciones
de invernadero (SCHUSTER y PATEL, 1985).
Los minadores son especies polivoltinas, en cualquier momento
pueden observarse los tres estados de su ciclo, si bien la
localización en la planta es diferente. En las hojas
viejas de la planta pueden observarse larvas de tercer estadio
y pupas, mientras que en las hojas jóvenes pueden observarse
picaduras recientes, huevos y larvas de primer estadio, así
como adultos revoloteando.

2.4.1.
Factores abióticos 
Los
factores que condicionan el desarrollo y el ciclo de los minadores
de hoja son fundamentalmente la temperatura, la humedad y
la luz. En las tablas III a V se
recogen a partir de diferentes la variación de algunos
factores biológicos para L. triffolii depencdeindo
de la temperatura.
Las poblaciones de L. trifolii no pueden sobrevivir
en áreas donde las temperaturas invernales sean inferiores
a cero grados de forma continuada (MILLER e ISGER, 1985),
ya que no presentan diapausa en estado de pupa, por lo que
las reinfestaciones en cultivos al aire libre son poco probables
en zonas frías (MINKENBERG, 1988b). Por el contrario
L. huidobrensis es mucho más tolerante al frío
que la especie anterior (SÁNCHEZ, 1994). Los umbrales
de temperatura de desarrollo son diferentes para cada especie
y estadio, e incluso dependen de la planta hospedante (MINKENBERG
y LENTEREN, 1986).
La temperatura letal superior o umbral superior de temperatura
está en 35-40 °C (SÁNCHEZ, 1994), aunque
según PEÑA (1986) es inferior y oscila entre
33-37 °C. En cuanto el umbral inferior de temperatura,
se encuentra a 9 °C según SÁNCHEZ (1994);
a 8,3 °C (ZOEBISCH et al., 1993) o 7,8 °C para L.
trifolii (SCHUSTER y PATEL, 1985).
En invierno se producen pocos adultos de L. bryoniae
debido a que las pupas entran en diapausa o se ralentiza mucho
el desarrollo.

2.4.2.
Plantas hospedantes 
Las
especies de minadores consideradas son muy polífagas,
en la Tabla VI se recogen las principales
hortalizas afectadas por estas especies. L. bryoniae
produce daños en tomate, sandía, melón,
pepino y lechuga, aunque ha sido criada en muchos géneros
de 23 familias de plantas diferentes. L. strigata ha
sido citada en acelga, lechuga y guisante y en otras 31 familias
de plantas. L. huidobrensis se ha registrado sobre
9 familias botánicas y produce daños principalmente
en acelga, espinaca, lechuga, melón, patata, tomate,
pimiento, habas, etc. L. trifolii ha sido citada en
once familias de plantas, entre las hortalizas destacan: pimiento,
tomate, cucurbitáceas, cebolla, zanahoria, patata,
judía verde, etc. (SPENCER, 1973).
Algunas especies de malas hierbas son mucho más apetecibles
para los minadores que las plantas cultivadas, por lo que
algunos autores han sugerido que un manejo correcto de estas
especies puede contribuir a controlar los minadores (CHANDLER
y CHANDLER, 1988). L. trifolii posee predilección
por el crisantemo frente a otras plantas u hortalizas, produciéndose
en esta planta el mayor número de puestas, longevidad
de las hembras y viabilidad de los huevos y larvas, al compararlas
con el apio y tomate (PARRELLA et al., 1983). Por el contrario
esta misma especie prefiere las plantas de tomate frente a
otras plantas o árboles (ZOEBISCH et al., 1981). También
se ha constatado que, en algunos casos, los adultos que proceden
de larvas criadas en una determinada planta hospedante, suelen
presentar preferencia por esa misma planta (ZOEBISCH y SCHUSTER,
1987b).

2.4.3.
Enemigos naturales 
2.4.3.1. Parasitoides
Los
enemigos naturales que afectan a los minadores son fundamentalmente
himenópteros parasitoides. Estos parasitoides pueden
ser endopárasitos y desarrollarse en el interior de
la larva de minador e incluso en el interior de la pupa, como
Opius pallipes Wesmael y Dacnusa sibirica Telenga;
o ectoparásitos como Diglyphus isaea Walker.
En la Tabla VII se han sintetizado
las especies citadas para cada uno de los cuatro minadores
en todo el Mundo.
Los parasitoides tienen capacidad para localizar las plantas
con minadores y diferenciar cuales están ya parasitadas.
También se ha constatado que algunas especies de parasitoides
presentan cierta predilección por determinadas plantas
(ZEHNDER y TRUMBLE, 1984b). El comportamiento de puesta de
los parasitoides es al azar, presenta un escaso grado de distribución
agregada o regular (CHANDLER y GILSTRAP, 1989).
De los parasitoides encontrados en los invernaderos del sur
de España, Chysonotomyia formosa es el más
eficaz, tanto por los porcentajes de parasitismo que alcanza,
como por el número de cultivos en los que aparece (CABELLO
et al., 1994).

2.4.3.2.
Depredadores 
Se
han citado algunos depredadores de minadores de hoja del género
Liriomyza, entre los que destacan una chinche Mírido,
Cyrtopaltis modestus, que depreda las larvas en cultivos
de tomates en el sur de California (PARRELLA et al., 1982).
También se han citado otras chinches como el género
Orius y Diciphus tamanii.
Igualmente se han citado algunos dípteros depredadores
de adultos que no tienen casi incidencia en el control de
minadores (VERCAMBRE, 1980); un díptero Dolicopódido
y una hormiga Porenina (PRIETO y CHACÓN, 1982).
Si bien el díptero Empídido Drapetis subaenescens
(Collin) consume un adulto de minador a la hora (FREIDBERG
y GIJSWIJT, 1983).

2.4.3.3.
Patógenos 
El
empleo de nemátodos como agentes patógenos para
el control de minadores se ha puesto de manifiesto mediante
diferentes ensayos (COLOMBO y LOCATELLI, 1985; HARRIS et al.,
1990; OLTHOF y BROADBENT, 1992; LEBECK et al., 1993).
HARA et al. (1996) ensayaron 20 cepas de nematodos para combatir
al minador L. trifolii, obteniendo mortalidades elevadas
en determinados casos, si bien es necesario un elevado grado
de humedad.
También se han realizado estudios para evaluar la eficacia
de hongos entomopatógenos sobre L. huidobrensis
(SOLÍS et al., 1998).

2.5.
Daños 
Los
daños que producen los minadores son de dos tipos:
el que efectúa la hembra con su ovipositor para alimentarse
y realizar la puesta, y el más importante, la galería
que produce la larva durante su alimentación. La forma
de esta galería varía según la especie,
planta hospedante y número de larvas por hoja (SÁNCHEZ,
1994). No obstante suele existir un patrón general,
de modo que L. trifolii y L. bryoniae suelen
realizar las galerías alargadas y tortuosas respetando
los nervios.
Por el contrario, L. strigata realiza las galerías
siguiendo los nervios principales de las hojas, produciendo
cortas digitaciones laterales. L. huidobrensis forma
galerías a lo largo del nervio central y secundarios,
así como varias galerías juntas en la base de
la hoja y en el envés, de modo que cuando se detectan,
los daños causados son ya de gran severidad (CABELLO
y BELDA, 1992). Aunque esta especie en el caso del pimiento
produce galerías entrecruzadas en todo el limbo de
la hoja (CABELLO et al., 1993a).
L. bryoniae es una plaga polífaga que debe ser
considerada como potencialmente peligrosa en un elevado número
de cultivos, como tomate y cucurbitáceas. La alimentación
de las larvas en los cotiledones y hojas de las plantas jóvenes
de tomate, melón, pepino y lechuga producen un debilitamiento
considerable de ésta, o bien conduce a un desarrollo
anormal e incluso pueden llegar a destruirlas. En plantas
mayores, densidades de hasta diez larvas por hoja producen
el marchitamiento y caída. En melón el ataque
de las larvas produce un endurecimiento y engrosamiento de
las hojas en la zona circundante a la galería. La deshidratación,
cuando afecta a numerosas hojas, produce también caídas
de frutos.
Aunque L. strigata es una especie muy polífaga y ha
de ser considerada como potencialmente dañina, no se
ha citado como causante de graves daños en cultivos.
Por otro lado, los minadores también producen daños
cosméticos en las plantas ornamentales y hortalizas
en las que se consumen las hojas.
Finalmente las picaduras de alimentación que practican
las hembras facilitan la entrada de patógenos como
el hongo Alternaria cucumerina; la bacteria Pseudomonas
cichorii (Swingle) (produce el moteado del crisantemo)
(BROADBENT y MATTEONI, 1990) e incluso los minadores pueden
ser vectores de virus como el del mosaico del apio, tabaco,
soja y sandía (MINKENBERG y LENTEREN, 1986; SÁNCHEZ,
1994).

2.6.
Métodos de control 
2.6.1. Umbrales económicos
Es
difícil correlacionar los niveles de daño con
la disminución del rendimiento y delimitar así
el umbral económico de tratamiento, ya que intervienen
varios factores como la susceptibilidad y el desarrollo de
la planta huésped, especie de minador presente, nivel
de parasitismo, etc. (SÁNCHEZ, 1991 y ELOSEGUI, 1995),
y variará dependiendo de sí es un cultivo tradicional
o de Lucha Integrada.
TRUMBLE et al. (1985) demostraron que una sola galería
de una larva de L. trifolii en una hoja de apio, produce
una reducción de más de un tercio de la capacidad
fotosintética y de transpiración. Porcentaje
que alcanza al 62 % en el caso de L. sativae en el
tomate, si bien no se conoce cual es la relación existente
entre la reducción de la capacidad fotosintética
y la producción, aunque parece ser que la reducción
no llega a comprometer la producción de fruto (JOHNSON
et al., 1980). LEDIEU y HELYER (1982) establecieron el nivel
en 15 galerías por hoja de tomate, siempre que éstas
estuviesen junto a los frutos; aunque posteriormente precisaron
que 30 minas por hojas, junto a ramilletes o cuando el fruto
está a medio crecer, producen unas pérdidas
del 10% de cosecha (LEDIEU y HELYER, 1985).
Por otro lado, se ha comprobado que una planta puede sufrir
una defoliación de hasta el 50% sin que afecte a la
cosecha, puesto que además suele afectar más
a las hojas inferiores que al perderse producen un incremento
de la fotosíntesis en las superiores.
CHANDLER y GILSTRAP (1987) señalan que el número
total de galerías por planta no es un buen indicador
del daño producido, sino que éste depende del
estado fenológico de la planta y la superficie total
foliar disponible.
No obstante, en cultivos de tomate en Florida, se utiliza
como umbral económico 0,7 larvas por trifoliolo en
la séptima hoja desde el ápice en cualquier
tallo (POHRONEZNY et al., 1986).

2.6.2.
Técnicas de muestreo 
El
muestreo de minadores es fundamental para la detección
de los primeros individuos, seguimiento de las poblaciones
y para establecimiento del grado de ataque de la plaga en
relación con umbral económico de daño.
El empleo de trampas cromáticas suele ser un método
habitual para detectar los primeros individuos y para la monitorización
de las poblaciones (ZEHNDER y TRUMBLE, 1985; PARRELLA y JONES,
1985; PARRELLA et al., 1987; ROBIN y MITCHELL, 1987), monitorización
de resistencias a insecticidas (HAYNES et al., 1986; SANDERSON
et al., 1989), captura de ejemplares marcados con polvo fluorescente
(JONES y PARRELLA, 1986a) y establecimiento de modelos para
el manejo de la plaga (ZOEBISCH et al., 1993).
Se han probado trampas cromáticas adhesivas de diferentes
colores, siendo las amarillas las más efectivas tanto
por el numero de capturas como por el número de especies
(SCHEIRS et al., 1997). Si bien estas trampas capturan generalmente
mayor número de machos que de hembras, a pesar de ser
éstas las que tienen mayor capacidad de vuelo. De hecho,
varios autores han puesto de manifiesto que las trampas cromáticas
no son efectivas como método de control, porque capturan
predominantemente machos (JONES y PARRELLA, 1986a; ZEHNDER
y TRUMBLE, 1984a). Si bien, CHANDLER (1985) no detecta grandes
diferencias en las capturas por sexos. Son trampas de eficacia
diurna, su eficacia es mayor a pocos centímetros del
dosel y no se ven afectadas por el tamaño y estado
fenológico de las plantas (CHANDLER, 1985).
No obstante, el uso de este tipo de trampas, si pueden aportar
con fiabilidad datos sobre el tamaño de la población
de adultos con aproximaciones hasta del 90%, aunque el empleo
de numerosas trampas en superficies muy extensas, supone un
gran volumen de muestras difícil de manejar que debe
compatibilizarse con muestreo de larvas y pupas (CHANDLER,
1987). Otros autores señalan que no son válidas
para evaluar la eficacia de las aplicaciones, porque éstas
producen un efecto repelente sobre las moscas desvirtuando
los datos.
El método habitual para determinar el grado de infestación
de minadores es el recuento de larvas en hoja, y también
es válido para evaluar la eficacia de los tratamientos
y el grado de parasitismo sobre la población. En plantas
pequeñas, de menos de 30 cm se suelen recoger 3 hojas
al azar, cuando las plantas adquieren un porte entre 30-50
cm se subdivide en dos zonas: alta y baja; y cuando es mayor
de 50 cm se realiza un muestreo estratificado recogiendo tres
hojas de cada una de las zonas de la planta: alta, media y
baja (JONES y PARRELLA, 1986b; PARRELLA et al., 1987). El
número de plantas de la muestra variará dependiendo
del tamaño de la parcela. Estas hojas serán
estudiadas en campo o en el laboratorio para evolucionar tanto
los minadores como los parasitoides, dependiendo de los datos
que se pretendan recoger. Han de anotarse las galerías
vacías, las que poseen larvas vivas y las que poseen
larvas parasitadas (CHANDLER y GILSTRAP, 1987).

2.6.3.
Métodos físicos y agronómicos 
En
este apartado se pueden considerar los métodos preventivos
como la utilización de material vegetal sano, fundamentalmente
las plántulas. Eliminación de las malas hierbas
dentro y próximas a las parcelas, así como los
restos de cosecha anteriores, pues actúan como reservorio
de la plaga.
En ataques fuertes, eliminar y destruir las hojas bajas de
las plantas. Barrido del suelo entre cultivos, con lo que
se eliminan un gran número de pupas; o incluso tratamientos
insecticidas al suelo o labrado profundo para enterrar las
pupas (cuando no sean enarenados). Evitar tanto el monocultivo,
como los cultivos asociados, pues favorecen el desarrollo
de la plaga.
Los métodos físicos se aplican fundamentalmente
en invernaderos y consisten en el empleo de mallas en los
laterales que impidan o retarden la presencia de la plaga,
y vigilar que no se produzcan roturas en el plástico
(MORENO et al., 1993).
El uso de trampas amarillas adhesivas consigue eliminar gran
número de adultos de minador y también sirve
para detectar las primeras infestaciones.
En la actualidad se están estudiando variedades resistentes
al ataque de los minadores, como en el caso del melón
(DOGIMONT et al., 1999), tomate (MOREIRA et al., 1999). Si
bien los minadores pueden ir adaptándose a lo largo
de generaciones a las plantas resistentes (HAWTHORNE, 1999b).

2.6.4.
Métodos químicos 
El
control químico de esta plaga es complicado porque
es difícil el acceso de los insecticidas a las larvas.
Además en estas especies de minadores se ha detectado
una rápida aparición de resistencias; e incluso
resistencias cruzadas (PEÑA, 1986 y ELOSEGUI, 1995)
contra todo tipo de insecticidas: organoclorados, organofosforados,
carbamatos y piretroides (MINKENBERG y LENTEREN, 1986). Se
ha comprobado que estas resistencias persisten después
de 15 generaciones no sometidas al efecto de las materias
activas a las que se han hecho resistentes (PARRELLA y TRUMBLE,
1989).
El responsable de estas resistencias parece ser el gen Kdr,
que en otros insectos causa la disminución de la efectividad
de los insecticidas clorados (SÁNCHEZ, 1986). Por ello
es importante alternar el uso de materias activas e incluso
de familias de productos autorizados para evitar estos fenómenos
de resistencia cruzada (PARRELLA, 1983; SÁNCHEZ, 1986
y 1994; APARICIO et al., 1998); así como permitir una
población remanente del 10% de los adultos y la disminución
de las aplicaciones y dosis (MASON et al., 1989).
Debido, precisamente, a la escasa accesibilidad que tienen
las larvas, es fundamental la utilización de productos
sistémicos o de alto poder de penetración, dirigidos
principalmente a los estados de huevo y larva (WEINTRAUB y
HOROWITZ, 1998). No obstante algunas materias activas producen
un efecto antialimentario en adultos y repelente de la oviposición
(ROBB y PARRELLA, 1985).
La lista de materias activas empleadas contra los minadores
de hoja en hortícolas es muy amplia, incluía
carbamatos, organoclorados, fosoforoclorados, piretroides
e inhibidores del crecimiento de insectos. A excepción
del último grupo, todos los demás insecticidas
tienen una alta incidencia sobre los enemigos naturales. En
la actualidad, ante las exigencias del mercado y las cada
vez más estrictas restricciones al uso de fitosanitarios,
el número de materias activas autorizadas es muy reducido.
La azadiractina (extracto de la semilla del árbol del
Neem) posee un algo grado de actividad ovicida y larvicida,
además de producir deformaciones en la pupa que impiden
le emergencia del adulto (STEIN y PARRELLA, 1985); pero también
afecta a los parasitoides.
Una circunstancia a tener en cuenta en el control de esta
plaga, es que determinados productos que se utilizan para
combatir las plagas de lepidópteros producen un incremento
de las poblaciones de minadores (JOHNSON et al., 1980), por
lo que han de evitarse cuando coincidan ambos tipos de plagas.
Los insecticidas autorizados para el control de los minadores
de hoja en hortícolas son: abamectina, aceite de verano,
ciromazina, diazinon y oxamilo (Tabla VIII).
Los dos primeros son insecticidas selectivos, no persistentes
en el medio ambiente, potencialmente compatibles con los enemigos
naturales y de baja toxicidad para mamíferos.
La abamectina es un insecticida acaricida, con acción
translaminar, procedente del microorganismo Streptomyces avermitilys.
Inhibe la transmisión neuromuscular. Se transloca rápidamente
manteniendo su actividad en el interior de la hoja y perdiéndola
en su superficie. Inhibe la oviposición de la hembra
y afecta a las larvas durante su eclosión y desarrollo.
Tiene un buen efecto sobre Liriomyza siempre que se realicen
dos tratamientos espaciados una semana (CABELLO et al., 1993b).
La ciromazina es un regulador del crecimiento de las larvas
de los minadores, actúa inhibiendo la síntesis
de la quitina tanto por contacto como por ingestión,
no tiene efecto directo sobre los adultos y posee cierto carácter
sistémico. Su persistencia en aplicaciones foliares
es de una semana y los resíduos desaparecen a las dos
semanas (WEINTRAUB, 1999). Aunque a determinadas dosis se
puede impedir el desarrollo de larvas neonatas durante un
periodo más prolongado; además, al ser un IGR
sus efectos no son inmediatos y ante una población
elevada de adultos, se hace necesario la aplicación
de otros insecticidas de actuación rápida (YATHOM
et al., 1986).
Tanto la abamectina como la ciromazina producen mortalidades
del 100% en larvas, semejantes a las que se obtienen con otras
materias activas fosforadas o permetrinas (SCHUSTER y EVERET,
1983).
Dosis subletales de IGR aplicados sobre larvas producen la
esterilidad en las hembras adultas que emergen de ellas y
de los machos que sobreviven (ROBB y PARRELLA, 1984).
La ciromazina es un IGR especialmente recomendado para larvas
de minadores, actúa por contacto e ingestión
y no tiene efecto sobre los adultos, aunque disminuye su fertilidad.
El diazinon es un organofosforado penetrante que actúa
por contacto, ingestión e inhalación. El oxamilo
es un insecticida sistémico de aplicación en
suelo por riego.

2.6.5.
Métodos biológicos 
2.6.5.1. Parasitoides
Para
el control biológico del género Liriomyza, existen
en el mercado himenópteros parasitoides que realizan
sus puestas en el interior de las galerías de las larvas
de los minadores.
En ocasiones estos parasitoides son autóctonos y se
producen masivamente para el control de la plaga, y en otras
son exóticos y se introducen desde otros países
donde han demostrado ser eficaces para el control de la plaga
(DREA et al., 1982; NEUENSCHWANDER et al., 1987). El método
recomendado para un control biológico de los minadores
es la suelta regular y periódica de lotes de parasitoides,
puesto que al tratarse de una plaga polivoltina el control
ha de ser continuo. Para la aplicación de éste
método es necesario tener datos muy precoces de incidencia
y las sueltas han de ser tempranas (WOETS y LINDEN, 1982),
puesto que los parasitoides requieren un tiempo para establecerse
(PARRELLA et al., 1987), y es condición indispensable
que no se hayan realizado previamente tratamientos químicos
en el cultivo que pudieran haber dejado residuos (MINKENBERG
y LENTEREN, 1986).
Los parasitoides comercializados en España son: Dacnusa
sibirica Telenga (Braconidae), Diglyphus
isaea (Walker) (Eulophidae); si bien en Europa
se utiliza de forma efectiva Opius pallipes Wesmael
(Braconidae).
Dacnusa sibirica Telenga es un endoparásito
que parasita todos los estadios de la larva y las pupas de
Liriomyza, aunque detecta mas rápidamente las
larvas de mayor tamaño. Es capaz de diferenciar larvas
ya parasitadas puesto que las hembras depositan una feromona
sobre las hojas que ya han visitado. El adulto emerge de las
pupas del suelo. Las sueltas de los adultos pueden ser: preventiva,
0,25 ejemplares/m2; normal, 0,5 ejemplares/m2 y curativa,
2 ejemplares/m2, realizando tres introducciones semanales.
Se comercializan en botes de 100 ml que contienen 250 individuos
adultos. Actualmente existen las siguientes presentaciones
en el mercado: DACNUSA System®, Biobest; DAC Line s®,
Syngenta Bioline; Dacnusa sibirica®, TCB; Minusa®,
Koppert.
D. isaea es efectivo en primavera y verano en cultivos de
tomate en invernadero (AKIHITO et al., 1999).
Diglyphus isaea (Walker) es un ectoparásito
gregario facultativo. La hembra paraliza la larva y deposita
sobre ella de 1-5 huevos. La larva es blanquecina y se vuelve
verdosa, pasando por tres estadios; pupa en la galería
del minador que perfora para emerger. Las hembras del himenóptero
también depredan minadores. Las sueltas de los adultos
pueden ser: preventiva, 0,2 ejemplares/m2, repitiendo el tratamiento
a las 2-3 semanas de la primera introducción si hay
menos del 70% de parasitismo (MALAIS y RAVENSBERG, 1991; RODRÍGUEZ
et al., 1994; SÁNCHEZ, 1994; ELOSEGUI, 1995). La dosis
normal es 0,1 ejemplares/m2 con tres introducciones semanales.
También se comercializan en botes de 100 ml que contienen
250 individuos adultos. Actualmente existen las siguientes
presentaciones en el mercado: DIG Line i®, Syngenta Bioline;
DIGLYPHUS®, Agrichem; DIGLYPHUS®, Agrobío;
DIGLYPHUS isaea®, TCB; DIGLYPAR, Plymag; DIGLYPHUS System®,
Biobest; MIGLYPHUS®, Koppert.
También existe en el mercado una presentación
mixta de ambos minadores: Dacnusa sibirica 90% + Diglyphus
isaea 10%. Se presentan en envases que contienen 225 individuos
de Dacnusa y 25 de Diglyphus. Las sueltas de
los adultos son: preventiva, 0,25 ejemplares/m2 semanalmente;
normal, 0,5 ejemplares/m2 y curativa, 2 ejemplares/m2, realizando
tres introducciones semanales. Las presentaciones que existen
en el mercado son: DACNUSA Mix System®, Biobest; MINEX®,
Koppert. O con una composición de ambas especies al
50% para uso preventivo como DIMINEX®, Koppert.
Opius pallipes Wesmael es un endoparásito solitario
de larvas de todos los estadios y pupas de minador. El adulto
emerge del pupario del hospedante. Es capaz de detectar plantas
con minadores o sin ellos y si las larvas están parasitadas
o no. Su efectividad es mayor que la de Diglyphus isaea.
Es el mejor candidato para controlar las poblaciones de L.
bryoniae. Se está utilizando ampliamente en cultivos
bajo plástico en Holanda y Reino Unido.

2.6.5.2.
Patógenos 
En
el norte de California ya se emplean nemátodos para
combatir los minadores de hoja (PARRELLA et al., 1982). Se
realizan aplicaciones de Steinernema carpocapsae (Weiser)
al suelo y bien la larva de tercer estadio es infectada al
caer al suelo para pupar o el adulto al emerger de la pupa.
Las aplicaciones foliares con Steinernema feltiae (Filipjev)
han producido eficacias elevadas, pero es necesario un elevado
grado de humedad y además también afecta a las
larvas de los parasitoides (WILLIAMS y WALTERS, 2000). No
obstante, SHER et al. (2000) proponen el uso combinado de
Steinernema carpocapsae y Dygliphus begini.
En España se comercializan los nemátodos Steinernema
feltiae y Heterorhabditis megidis, el primero para
controlar larvas de dípteros en suelo en cultivos de
champiñón, y el segundo contra larvas de gorgojos
que afectan a cultivos hortícolas. Pero ninguno de
los formulados de estos nemátodos está autorizado
contra dípteros minadores en hortícolas.

2.6.6.
Métodos de Lucha Integrada 
La
Lucha Integrada contra los minadores de hoja se ha revelado
como un método muy eficaz para combatir esta plaga,
ya que en determinadas zonas, como el sudeste de Francia,
sólo el control biológico por medio de los enemigos
naturales ha permitido controlar los minadores (VILLEVIEILLE,
1986).
El propósito del control integrado es minimizar la
distorsión que produce el control de plagas sobre el
agrosistema. Por ello uno de los aspectos a considerar es
la compatibilidad del control químico con el biológico
y otras medias culturales.
En algunas de las Comunidades Autónomas de nuestro
país ya se han ido publicando reglamentos específicos
para de Producción Integrada para cultivos concretos,
como por ejemplo en Cataluña entre los años
2001 y 2002, en Baleares en 2002, en Extremadura en 2001.
Si bien fue la comunidad Andaluza los primeros reglamentos
datan de 1998 y han sido actualizados y ampliados en el 2001.
Así, el Reglamento específico de Producción
Integrada en cultivo de tomate bajo abrigo de esta Comunidad
establece, como umbral de intervención un nivel superior
al 20% de las hojas con galería sin parasitar.
En cultivo de melón y pepino el Reglamento específico
determina el umbral hasta la floración, con la presencia
de galerías sin parasitar, y después del cuajado
intervenir en ausencia de parasitismo. En cultivo de sandía
se establece como umbral de intervención, la presencia
de galerías y riesgo de penetración al tallo
cuando la planta es pequeña. Para el caso de la judía
el umbral se establece en la primera presencia de galerías
sin parasitar. El conjunto de materias activas autorizadas
y sus restricciones en Producción Integrada se recogen
en la Tabla IX.
La abamectina tiene un efecto mínimo sobre las larvas
y adultos de los parasitoides de los minadores, con lo que
es la materia idónea para la Producción Integrada;
mientras que la ciromazina, aunque respeta los adultos de
la fauna auxiliar, produce una gran pérdida de las
inmaduros de los parasitoides (TRUMBLE, 1985).
El oxamilo ejerce un buen control sobre las poblaciones de
minadores, reduciéndolas a niveles inferiores del umbral
económico de daño; sin embargo han de realizarse
aplicaciones aisladas que no afectan a la emergencia de los
parasitoides, ya que más de una aplicación en
un plazo de tres semanas afecta a la emergencia de éstos
(SCHUSTER y WHARTON, 1993).

3.
CONCLUSIONES Y RECOMENDACIONES 
tLos dípteros agromícidos son un serio problema
en los cultivos hortícolas, tanto al aire libre como
bajo plástico. Si bien aún no se ha podido cuantificar,
en porcentaje de pérdidas, el daño que producen,
salvo en ataques extremadamente severos.
Por otro lado también es necesario el establecimiento
de los umbrales económicos para cada cultivo; aunque
éste es un problema que afecta al control de plagas
en todos aquellos cultivos en los que aún no se ha
elaborado el reglamento específico de producción
integrada. No obstante la demanda del mercado y tendencias
conservacionistas conducen a un uso mucho más racional
de la lucha química y a un desarrollo pleno de la lucha
biológica. Aunque en este sentido, hay que apostar
por la implantación de enemigos naturales autóctonos.
El estudio de las poblaciones permite constatar la evolución
de éstas, así, se ha podido comprobar que L.
huidobrensis fue una especie que se introdujo a inicios
de los noventa, y presentó un comportamiento muy agresivo
con elevado número de individuos y daños severos,
desplazando incluso a las otras especies congéneres
presentes. Sin embargo, en el último quinquenio, las
poblaciones de esta especie han disminuido considerablemente;
de modo que en los tres últimos años los muestreos
en el sudeste peninsular reflejan la presencia mayoritaria
de L. trifolii y L. bryoniae.
Sin embargo, como ya se ha mencionado, ante la detección
y posterior confirmación por la OILB en 2000 de L.
sativae en Francia, debemos establecer las máximas
medidas para evitar su expansión y para detectar su
posible introducción; teniendo en cuenta además
que esta especie, posee una gran capacidad de transmisión
de fitopatógenos.

4.
BIBLIOGRAFÍA 
AKIHITO, O., T. SAITO Y M. OTA 1999. Biological control of
the American serpentine leafminer, Liriomyza trifolii (Burguess),
on tomato greenhouses by parasitoids. I. Evaluation of biological
control by realase of Diglyphus isaea (Walker) in experimental
greenhouses. Jpn. J. Appl. Entomol. Zool., 43: 161-168.
ALCÁZAR, M.D., J. E. BELDA, P. BARRANCO Y P. CABELLO
2000. Lucha integrada en cultivos hortícolas bajo plástico
en Almería. Vida Rural, 118: 51-55.
APARICIO, V., J. E. BELDA, E. CASADO, M. M. GARCÍA,
V. GÓMEZ, J. LASTRES, E. MIRASOL, E. ROLDÁN,
E. SÁEZ, A. SÁNCHEZ Y M. TORRES 1998. Plagas
y enfermedades en cultivos hortícolas de la provincia
de Almería: control racional. Dir. Gral. Inv. y Form.
Agraria. Junta de Andalucía. Sevilla, 356 pp.
BARLETT, P.W. Y D. F. POWELL 1981. Introduction of American
serpentine leaf miner, Liriomyza trifolii, into England and
Wales and its erradication from commercial nurseries, 1977-81.
Pl. Path., 30: 185-193.
BETHKE, J.A. Y M. P. PARRELLA 1985. Leaf puncturing, feeding
and oviposition behavior of Liriomyza trifolii. Entomol. exp.
appl., 39: 149-154.
BROADBENT, A.B. Y L. A. MATTEONI 1990. Acquisition and transmission
of Pseudomonas cichorii by Liriomyza trifolii (Dipter: Agromyzidae).
Proc. Soc. Ontario, 121: 79-84.
CABELLO, T., A. CONSTAN Y F. PASCUAL 1990. Estudio preliminar
sobre las especies de Liriomyza (Diptera, Agromyzidae) y sus
parasitoides en cultivos hortícolas en invernaderos
del sur de España. Bol. San. Veg. Plagas, 16: 426.
CABELLO, T. Y J. E. BELDA 1992. Liriomyza huidobrensis (Blanchard,
1926) (Diptera: Agromyzidae) nueva especie plaga en cultivos
hortícolas en invernaderos de España. Phytoma,
42: 37-43.
CABELLO, T., J. BELDA, R. JÁIMEZ Y F. PASCUAL 1993a.
Caracterización de daños debidos a la especie
plaga introducida: Liriomyza huidobrensis (Diptera: Agromyzidae)
en cultivos hortícolas en invernaderos del sur de España.
Hortofruticultura, 4: 43-46.
CABELLO, T., R. JÁIMEZ, J. E. BELDA Y F. PASCUAL 1993b.
El minador sudamericano. Una nueva plaga de los cultivos hortícolas.
Hortofruticultura, 5: 43-46.
CABELLO, T., R. JÁIMEZ Y F. PASCUAL 1994. Distribución
espacial y temporal de Liriomyza spp. y sus parasitoides en
cultivos hortícolas en invernaderos del sur de España
(Dip., Agromyzidae). Bol. San. Veg. Plagas, 20: 445-455.
CARLES-TOLRÁ, M. 2002 (Coord.). Catálogo de
los Díptera de España, Portugal y Andorra (Insecta).
Monografías SEA, vol. 8, 323 págs, Zaragoza.
COLOMBO, M. Y D. P. LOCATELLI 1985. Valutazione in laboratorio
dell'attivita di Steinernema feltiae Filip. e Heterorhabditis
spp. su Liriomyza trifolii (Burgess) e Opogona sacchari (Bojer)
infestanti le coltivazioni floricole. La Difesa delle Piante,
8: 263-269.
CHANDLER, L.D. 1985. Flight activity of Liriomyza trifolii
(Diptera, Agromyzidae) in relationships to deplacement of
yellow traps in bell peppers. J. Econ. Entomol., 78: 825-828.
CHANDLER, L.D. 1987. Evaluation of yellow trap sizes and within-field
densities for monitoring Liriomyza trifolii in bell peppers.
Southern Entomol., 12: 245-251.
CHANDLER, L.D. Y J. M. CHANDLER 1988. Comparative host suitanility
of bell pepper and selected weed species for Liriomyza trifolii
(Burguess). Southern Entomol., 13: 137-146.
CHANDLER, L.D. Y F. E. GILSTRAP 1987. Seasonal fluctuation
and age structure of Liriomyza trifolii (Diptera, Agromyzidae)
larval population on bell peppers. J. Econ. Entomol., 80:
102-106.
CHANDLER, L.D. Y F. E. GILSTRAP 1989. Dispersion patterns
of parasitized Liriomyza trifolii larvae in bell peppers.
Southwestern Entomol., 14: 1-8.
DOGIMONT, C., D. BORDAT, C. PAGES, N. BOISSOT Y M. PITRAT
1999. One dominant gene conferring the resistance to the leafminer
Liriomyza trifolii (Burguess) Diptera, Agromyzidae in melon
(Cucunis melo L.). Euphytica, 105: 63-67.
DREA, J.J., D. JEANDEL Y F. GRUBER 1982. Parasites of agromyzid
leafminer (Dipter: Agromyzidae) on alfalfa in Europe. Ann.
Entomol. Soc. Am., 75: 297-310.
ELOSEGUI, E. 1995. La mosca minadora Liriomyza huidobrensis,
plaga de horícolas y ornamentales. Sustrai, 37: 22-24.
EPPO 1984. Fiches informatives OEPP sur les organismes de
quarantaine. Liriomyza trifolii (Burguess). EPPO Bull., 14:
29-37.
EPPO 2000. Identification of Liriomyza sativae on imports
from Israel 2000/166. EPPO Reporting Service, 11: 3.
FAGOONEE, I. Y V. TOORY 1983. Preliminary investigations of
host selection mechanisms by the leafminer Liriomyza trifolii.
Insect. Sci. Application, 4: 337-341.
FREIDBERG, A. Y M. J. GIJSSWIJT 1983. A list and preliminary
observations on natural enemies of the leaf miner, Liriomyza
trifolii (Burguess) (Diptera: Agromizydae) in Israel. Israel
J. Entomol., 27: 115-116.
HAMMAD, E.M.A. Y N. M. NEMER 2000. Population densities, spatial
pattern and development of the pea leafminer (Diptera: Agromyzidae)
on cucumber, swisschard and bean. J. Agr. Sci., 134: 61-68.
HARA, A.H, H. K. KAYA, R. GAUGLER, L. M. LEBECK Y C. L. MELLO
1996. Entomopathogenic nematodes for biological control of
leafminer, Liriomyza trifolii (Dipt.: Agromyzidae). Entomophaga,
38(3): 359-369.
HARRIS, M.A., J. W. BEGLEY Y D. L. WARKENTIN 1990. Liriomyza
trifolii (Diptera: Agromyzidae) suppression with foliar applications
of Steinernema carpocapsae (Rhabditida: Steinernematidae)
and abamectin. J. Econ. Entomol., 83: 2380-2384.
HAWTHORNE, D.J. 1999a. Ecological history and evolution in
a novel environment-habitat heterogeneity and insect adaptation
to a new host. Evolution, 51: 153-162.
HAWTHORNE, D. J. 1999b. Physiological not behavioral adaptations
of leafminers to a resistant host plant: a natural selection
experiment. Environ. Entomol., 28: 696-702.
HAYRES, K.F., M. P. PARRELLA, J. T. TRUBLE Y T. A. MILLER
1986. Monitoring insecticide resistance with yellow sticky
cards. California Agriculture, Nov.-Dec., 11-12.
INBAR, M., H. DOOSTDAR, G. L. LEIBEE Y R. T. MAYER 1999. The
role of rapidly plant induced reponses in asymetric interspecific
interactions among insect herbivores. J. Chem. Ecol., 25:
1961-1979.
JONES, V. P. Y M. P. PARRELLA 1986a. The movement and dispersal
of Liriomyza trifolii (Diptera: Agromizydae) in a chrysantemum
greenhouse. Ann. Appl. Biol., 109: 33-39.
JONES, V.P. Y M. P. PARRELLA 1986b. Development of sampling
strategies for larvae of Liriomyza trifolii (Diptera: Agromyzidae)
in chrysantemums. Environ. Entomol., 109: 33-39.
JOHNSON, M.W., E. R. OATMAN Y J. A. WYMAN 1980. Effects of
insecticides on populations of the vegetable leafminer and
associated parasites on Fall Pole tomatoes. J. Econ. Entomol.,
73: 67-71.
KUMAR, P., D. MANJUNATH, K. S. PRASAD, R. KISHORE, V. KUMAR
Y R. K. DATTA 1993. Integrated management of the uzi fly,
Exorista bombycis (Louis) (Diptera: Tachinidae), a parasitoid
of the silkworm, Bombyx mori L. International Journal of Pest
Management, 39: 445-448.
LEBECK, L.M., R. GAUGLER, H. K. KAYA, A. H. HARA Y M. W. JOHNSON
1993. Host stage suitability of the leafminer Liriomyza trifolii
(Diptera, Agromyzidae) to the entomopathogenic nematode Steinernema
carpocapsae (Rhabditida, Steinernematidae). J. Invert. Pathol.,
62: 58-63.
LEDIEU, M.S. Y N. L. HELYER 1982. Effect of tomato leaf miner
on yield of tomatoes. Annu. Rep. GCRI 1981, Littlehampton,
108.
LEDIEU, M.S. Y N. L. HELYER 1985. Observation on the economic
importance of tomato leaf miner (Liromyza trifolii) (Agromyzidae).
Agriculture, Ecosystems and Environment, 13: 103-109.
LEIBEE, G. L. 1984. Influence of temperature on development
of Liriomyza trifolii (Burguess) (Diptera: Agromyzidae) on
celery, Environ. Entomol., 13: 497-501.
LEIBEE, G. L. 1988. Toxicity of abamectin to Liromyza trifolii
(Burguess) (Diptera: Agromyzidae). J. Econ. Entomol., 81:
738-740.
MALAIS, M. Y W. J. RAVENSBERG 1991. La biología de
las plagas de invernadero y sus enemigos naturales. Conocer
y reconocer. Kopper Biological Systems. Rotterdam. 110 págs.
MASON, G.A., B. E. TABASHNIK Y M. W. JOHNSON 1989. Effects
of biological and operational factor on evolution of insecticide
resistance in Liriomyza (Diptera, Agromyzidae). J. Econ. Entomol.,
82: 369-373.
MENKEN, S.B.J. Y S. A. ULENBERG 1983. Diagnisis of the agromizids
Liriomyza bryoniae and L. trifolii by means of atrch gel electrophoresis.
Ent. Exp. Appl., 34: 205-208.
MILLER, G. W. Y M. B. ISGER 1985. Effects of temperature on
th development of Liriomyza trifolii (Burguess) (Diptera:
Agromyzidae). Bull. Ent. Res., 75: 321-328.
MINKENBERG, O.P.J.M., 1988a. Dispersal of Liriomyza trifolii,
Bulletin EPPO, 18: 173-182.
MINKENBERG, O.P.J.M., 1988b. Life history of the agromyzid
Liriomyza trifolii on tomato at different temperatures. Entomol.
Exp. Appl., 48: 73-84.
MINKENBERG, O.P.J.M. Y J. C. VAN LENTEREN 1986. The leafminers
Liriomyza bryoniae and L. trifolii (Diptera: Agromyzidae),
their parasites and host plants: a review. Agr. Univ. Wageningen
Papers, 86-2: 1-50.
Moreira, L.A., C. MOLLEMA Y S. VAN HEUSDEN 1999. Search for
molecular markers linked to Liriomyza trifolii resistance
in tomato. Euphytica, 109: 149-156.
MORENO, R., M. M. TÉLLEZ, E. BENÍTEZ, J. GÓMEZ,
M. D. RODRÍGUEZ, E. SÁEZ, J. BELDA, R. CAÑERO
Y T. CABELLO 1993. Lucha integrada. Aplicación en los
cultivos bajo plástico del sur de España. Hotofruticultura,
1: 41-54.
MORGAN, D.J.W., S. R. REITZ, P. W. ATKINSON Y J. T. TRUMBLE
2000. The resolution of californian populations of Liriomyza
huidobrensis and Liriomyza trifolii (Diptera: Agromyzidae)
using PCR. Heredity, 85: 53-61.
NEUENSHWANDER, P., S. P. MURPHY Y E. V. COLY 1987. Introduction
of exotic parasitic wasps for the control of Liriomyza trifolii
(Diptera: Agromyzidae) in Senegal. Tropical Pest Management,
33: 290-297.
OETTING, R.D. 1983. The influence of selected substrates on
Liriomyza trifolii emergence. J. Georgia Entomol. Soc., 18:
112-120.
OLTHOF, T.H.A. Y A. B. BROADBENT 1992. Evaluation of steinermatid
nematodes for control of a leafminer, Liriomyza trifolii,
in greenhouse chrysanthemums. J. Nematol., 24: 612.
PARRELLA, M.P. 1983. Intraspecific competition among larvae
of Liriomyza trifolii (Diptera: Agromyzidae): effects on colony
production. Environ. Entomol., 12: 1412-1414.
PARRELLA, M.P. Y V. P. JONES 1985. Yellow traps as monitoring
tools for Liriomyza trifolii (Diptera: Agromyzidae) in chrysanthemum
greenhouses. J. Econ. Entomol., 78: 53-56.
PARRELLA, M.P., V. P. JONES Y G. D. CHRISTIE 1987. Feseability
of parasites for biological control of Liriomyza trifolii
(Diptera: Agromyzidae) on commercially grown chrysanthemum,
Environ. Entomol., 16: 832-837.
PARRELLA, M.P., K. L. ROBB Y J. BETHKE 1983. Influence of
selected host plant on the biology of Liriomyza trifolii (Diptera:
Agromyzidae). Ann. Entomol. Soc. Am., 76: 112-115.
PARRELLA, M.P., K. L. ROBB, G. D. CHRISTIE Y J. BETHKE 1982.
Control of Liriomyza trifolii with biological agents and insect
growth regulators. California Agriculture. Nov.-Dec, 17-19.
PARRELLA, M.P. Y J. T. TRUMBLE 1989. Decline of resistance
in Liriomyza trifolii (Dipter: Agromyzidae) in the absence
of insecticide selection pressure. J. Econ. Entomol., 82:
365-368.
PASCUAL, F., J. E. BELDA Y T. CABELLO 1992. Liriomyza huidobrensis
(Blanchard, 1926) nueva especie para España (Diptera:
Agromyzidae). Zoologica Baetica, 3: 159-165.
PEÑA, M.A. 1986. Biología y control de Liriomyza
trifolii (Burguess, 1880) (Diptera, Agromyzidae. Cuadernos
de Fitopatología, 8: 105-129.
PEÑA, M.A. 1988. Primeras experiencias de lucha biológica
contra Liriomyza trifolii (Burg.) (Dipt.: Agromyzidae) con
Diglyphus isaea (Walk.) (Hym.: Eulophidae) en las Islas Canarias.
Bol. San. Veg., Plagas, 14: 439-445.
POHRONEZNY, K., V. H. WADDILL, D. J. SCHSTER Y R. M. SONODA
1986. Integrated pest manegement for Florida tomatoes. Plant
Dis., 70: 96-102.
POWELL, D.F. 1981. The eradication campaign against American
serpentine leaf miner, Liriomyza trifolii, at Efford Experimental
Horticulture Station. Pl. Path., 30: 195-204.
PRIETO, A. J. Y P. CHACÓN 1982. Biología y ecología
de Liromyza trifolii Burguess (Diptera: Agromyzidae) minador
del crisantemo en el departamento del valle de Cauca. Revista
Colombiana de Entomología, 6: 77-84.
ROBB, K.L. Y M. PARRELLA 1984. Subletal effects of two insect
Growth Regulators applied to larvae of Liromyza trifolii (Diptera:
Agromyzidae). J. Econ. Entomol., 77: 1288-1292.
ROBB, K.L. Y M. PARRELLA 1985. Antifeed and oviposition-deterring
effect of insecticides on adults Liromyza trifolii (Diptera:
Agromyzidae). J. Econ. Entomol., 78: 709-713.
ROBIN, M.R. Y W. C. MITCHELL 1987. Sticky trap for monitoring
leafminers Liriomyza sativae and Liriomyza trifolii (Diptera:
Agromyzidae) and their associated hymenopterous parasites
in watermelon. J. Econ. Entomol., 80: 1345-1347.
RODRÍGUEZ, M.D., R. MORENO, M. P. RODRÍGUEZ,
J. M. LASTRES, M. M. TÉLLEZ Y E. MIRASOL 1994. IPM
Tomate. Programa de manejo integrado en cultivo de tomate
bajo plástico en Almería. Comunicación
I+D Agroalimentario, 4/93. Junta de Andalucía. Sevilla.
82 págs.
SÁNCHEZ, J.M. 1986. Contribución al conocimiento
de minadores de hojas in Liriomyza spp. (Diptera: Agromyzidae)
en Hortalizas. II Simposium Nacional de Agroquímicos,
Sevilla, 29 pp.
SÁNCHEZ, J.M. 1991. Control biológico en los
cultivos hortícolas protegidos. Phytoma España,
29: 17-22.
SÁNCHEZ, J.M. 1994. Agromícidos minadores en
hojas. En: Moreno, R. (Ed.). Sanidad vegetal en horticultura
protegida. Junta de Andalucía. Consejería de
Agricultura y Pesca. Sevilla. 223-240.
SANDERSON, J.P., M. P. PARRELLA Y J. T. TRUMBLE 1989. Monitoring
insecticide resistance in Liriomyza trifolii (Diptera: Agromyzidae)
with yellow sticky cards. J. Econ. Entomol., 82: 1011-1018.
SCHEFFER, S.J. 2000. Molecular evidence of cryptic species
within Liriomyza huidobrensis (Diptera: Agromyzidae). J. Econ.
Entomol., 93: 1146-1151.
SCHEIRS, L., L. DE BRUYN Y M. VON TSCHIRNHAUS 1997. Comparison
of different trapping methods in Agromyzidae (Diptera). J.
Appl. Ent., 121: 429-433.
SCHUTER, D.J. Y P. H. EVERET 1983. Reponse of Liromyza trifolii
(Diptera: Agromyzidae) to insecticides on tomato. J. Econ.
Entomol., 76: 1170-1174.
SCHUSTER, D.J. Y K. J. PATEL 1985. Development of Liromyza
trifolii (Diptera: Agromyzidae) larvae on tomato at constant
temperatures. Florida Entomol., 68: 158-161.
SCHUSTER, D.J. Y R. A. WHARTON 1993. Hymenopterous parasitoids
of leaf-mining Liriomyza ssp. AGROMYZIDAE (DIPTERA) ON TOMATO
IN FLORIDA. ENVIRON. ENTOMOL., 22: 1188-1191.
SHER, R.B., M. P. PARRELLA Y H. K. KAYA 2000. Biological control
of the leafminer Liriomyza trifolii (Burguess): Implication
for intraguild predation between Diglyphus begini Ashmed and
Steinernema carpocapsae (Weiser). Biol. Control, 17: 155-163.
SOLÍS, F.S., D. DARDÓN Y S. WELLER 1998. Evaluación
de los hongos entomopatógenos Metarhizium anisopliae
y Beauveria bassiana para el control biológico de la
mosca minadora (Diptera: Agromyzidae: Liriomyza huidobrensis)
en el cultivo de la arveja china (Pisum sativum). IPM CRSP,
sept.-oct.
SPENCER, K.A. 1973. Agromyzidae (Diptera) of economic importance.
Series Entomologica. Vol. 9. Junk Ed., The Hague, 418 pág.
STEIN, U. Y M. P. PARRELLA 1985. Seed extract shows promise
in leafminer control. California Agriculture, 19-20.
TRUMBLE, J.T. 1985. Integrated Pest Management of Liriomyza
trifolii: influence of avermectin, cyromazine, and methomyl
on leafminer ecology in celery. Agriculture, Ecosystems and
Environmental, 12: 181-188.
TRUMBLE, J.T., I. P. TING Y L. BATES 1985. Analysis of physiological,
growth, and yield reponses of celery to Liriomyza trifolii.
Entomol. Exp. Appl., 38: 15-21.
VERCAMBRE, B. 1980. Ëtudes reálisées a
la Réunion sur la mouch maraichère: Liriomyza
trifolii Burgess. Revue Agricole de la Sucrière de
l'Ile Maurice, 59: 147-157.
VILLEVIELLE, M. 1986. Historique de la lutte contre Liriomyza
trifolii dans le Sud-Est de la France. Les Colloques de l'INRA,
34: 99-103.
WEINTRAUB, P.G. 1999. Effect of cyromazine and abamectin on
the leafminer, Liriomyza huidobrensis and its parasitoid,
Diglyphus isaea in celery. Ann. Appl. Biol., 135: 547-554.
WEINTRAUB, P. G. Y A. R. HOROWITZ 1998. Effects of translaminar
versus conventional insecticides on Liriomyza huidobrensis
(Diptera: Agromyzidae) and Diglyphus isaea (Hymenoptera: Eulophidae)
population in celery. J. Econ. Entomol., 91: 1180-1185.
WILLIAMS, E.C. Y K. F. A. WALTERS 2000. Foliar application
of the entomopathogenic nematode Steinernema feltiae against
leafminers on vegetables. Biocontrol Sci. Technol., 10: 61-70.
WOETS, J. Y A. VAN DER LINDEL 1982. On the occurence of Opius
pallipes Wesmael and Dacnusa sibirica Telenga (Braconidae)
in cases of natural control of tomato leafminer Liriomyza
bryoniae Kalt. (Agromyzidae) insome large greenhouses in the
Netherlands. Med. Fac. Landboww, Rijksuniv. Gent, 42.
YATHOM, S., K.R.S. ASCHER, S. TAL Y N. E. NEMMY 1986. The
effect of ciromazine on different stages of Liriomyza trifolii
(Burguess) (Diptera: Agromyzidae). Israel J. Entomol., 20:
85-93.
YEATES, D. K. Y B. M. WIEGMANN 1999. Congruence and controversy:
Toward a higher-level phylogeny of Diptera. Ann. Rev. of Entomol.,
44: 397-428.
ZACHARIADES, C., L. W. STRATHIE-KORRUBEL Y R. L. KLUGE 1999.
The South African programme on the biological control of Chromalaena
odorata (L.) King & Robinson (Asteraceae) using insect.
Afr. Entomol., 89-102.
ZEHNDER, G.H. Y J. T. TRUMBLE 1984a. Host selection of Liriomyza
species (Diptera: Agromizydae) and associated parasites in
adjacent plantings of tomato and celery. Environ. Entomol.,
13: 492-496.
ZEHNDER, G.H. Y J. T. TRUMBLE 1984b. Spatial and diel activity
of Liriomyza (Diptera: Agromyzidae) in fresh market tomatoes.
Environ. Entomol., 13: 1411-1416.
ZEHNDER, G.H. Y J. T. TRUMBLE 1985. Sequential sampling plans
with fixel levels of precision for Liriomyza species (Diptera:
Agromyzidae) in fresh market tomatoes. J. Econ. Entomol.,
78: 138-142.
ZEHNDER, G.H., J. T. TRUMBLE Y W. R. WHITE 1983. Discrimination
of Liriomyza species (Diptera: Agromyzidae) using electrophoresis
and scanning electron microscopy. Proc. Entomol. Soc. Wash.,
85: 564-574.
ZOEBISCH, T.G., D. J. SCHUTER Y J. P. GILREATH 1981. Liriomyza
trifolii: oviposition and development in foliage of tomato
and common weed hosts. Florida Entomol., 67: 250-254.
ZOEBISCH, T.G. Y D. J. SCHUTER 1987a. Longevity and fecundity
of Liriomyza trifolii (Diptera: Agromyzidae) exposed to tomato
foliage and honeydew in laboratory. Environ. Entomol., 16:
1001-1003.
ZOEBISCH, T.G. Y D. J. SCHUTER 1987b. Suitability of foliage
of tomatoes and three weed host for oviposition and development
of Liriomyza trifolii (Diptera: Agromyzidae). J. Econ. Entomol.,
80: 758-762.
ZOEBISCH, T.G., J. L. STIMATIC Y D. J. SCHUTER 1993. Methods
for estimating adult densities of Liriomyza trifolii (Diptera:
Agromyzidae) in staked tomato fileds. J. Econ. Entomol., 86:
523-528.
 Tabla I. Duración de los diferentes estados a diferentes
temperaturas
Tabla I. Duración de los diferentes estados a diferentes
temperaturas
para las especies más polífagas, así
como sus temperaturas umbrales
| Estado |
Temperatura
|
L.huidobrensis
|
L.
trifolii
|
L.
bryoniae
|
| HUEVO |
15-25
°C
|
–
|
4,0-7,7
|
3,0-6,1
|
|
25-27
°C
|
2,1-3,0
|
–
|
–
|
| LARVA |
20-25
°C
|
5,8-6,7
|
–
|
–
|
|
15-25
°C
|
–
|
4,3-9,1
|
5,0-12,3
|
| PUPA |
15-25
°C
|
–
|
10,0-26,6
|
9,2-22,2
|
|
20-27
°C
|
9-12,6
|
–
|
–
|
| Umbrales |
|
| Mínimo |
–
|
7,3
°C
|
10,0
°C
|
15,0
°C
|
| Óptimo |
–
|
20,0
°C
|
30,0
°C
|
25,0
°C
|
| Máximo |
–
|
30,0
°C
|
37,0
°C
|
35,0
°C
|
| Longevidad |
19
°C
|
11,42
|
–
|
–
|
|
15-38
°C
|
–
|
3,1-16,7
|
–
|
|
15-25
°C
|
–
|
–
|
6,6-13,6
|
|
 Tabla II. Fecundidad y longevidad en diferentes
Tabla II. Fecundidad y longevidad en diferentes
huéspedes (26-27 °C) para L. trifolii
| HUESPED |
N.M.P.
|
N.M.H/H
|
L.H.
|
%H/P.A.
|
%S.L.
|
| Crisantemo |
1343
|
298
|
14
|
|
85
|
| Apio |
986
|
212
|
12
|
24
|
78
|
| Tomate |
353
|
139
|
10
|
10
|
58
|
|
______
N.M.P. = Nº medio de picaduras de alimentación
N.M.H/H = Nº medio de huevos/hembra
L.H. = Longevidad hembras
%H/P.A.= % huevos/picaduras de alimentación
%S.L. = % supervivencia de larvas
 Tabla III. Duración media del ciclo en días
de L. trifolii
Tabla III. Duración media del ciclo en días
de L. trifolii
según el cultivo y la temperatura
| TEMPERATURA |
15°C
|
20°C
|
25°C
|
30°C
|
35°C
|
| Apio |
64
|
30
|
185
|
16
|
14
|
| Judía |
51
|
205
|
16
|
125
|
12
|
| Tomate |
445
|
265
|
17
|
-
|
-
|
|
 Tabla IV. Duración media del ciclo, fecundidad
Tabla IV. Duración media del ciclo, fecundidad
y mortalidad de L. trifolii según la temperatura
| TEMPERATURA |
15°
|
20°
|
25°
|
| Ciclo
(días) |
44
|
25
|
17
|
| %
Mortalidad |
73
|
48
|
60
|
| Nº
medio de picaduras |
339
|
1406
|
914
|
| Fecundidad |
5
|
79
|
59
|
| Longevidad |
7
|
14
|
6
|
|
|
|
|
|
 Tabla V. Duración media de los estados de L.trifolii
Tabla V. Duración media de los estados de L.trifolii
a diferentes temperaturas en apio (LEIBEE, 1984)
Tª °C |
HUEVO
(dias)
|
LARVA
(días)
|
Prepupa
(horas)
|
PUPA
(días)
|
Total
Ciclo
(días)
|
| 35° |
2
|
54
|
27
|
67
|
14
|
| 30° |
24
|
68
|
33
|
68
|
159
|
| 25° |
23
|
8
|
38
|
84
|
187
|
| 20° |
44
|
12
|
5
|
134
|
298
|
| 15° |
10
|
258
|
–
|
282
|
64
|
|
 Tabla VI. Principales hortalizas afectadas por los
Tabla VI. Principales hortalizas afectadas por los
minadores de hoja del género Liriomyza (x)
|
|
L.
bryoniae
|
L.
strigata
|
L.
huidobrensis
|
L.
trifolii
|
| Pimiento |
Capsicum
sp. |
–
|
–
|
x
|
x
|
| Tomate |
Lycopersicum
esculentum
Mill. |
x
|
–
|
x
|
x
|
| Patata |
Solanum
tuberosum L. |
–
|
–
|
x
|
x
|
| Berenjena |
Solanum
melongena L. |
–
|
–
|
–
|
x
|
| Judía
verde |
Phaseolus
sp. |
x
|
–
|
x
|
x
|
| Guisante |
Pisum
sativum L. |
–
|
x
|
x
|
x
|
| Haba |
Vicia
faba L. |
–
|
–
|
x
|
x
|
| Cebolla |
Allium
cepa L. |
–
|
–
|
x
|
x
|
| Melón |
Cucumis
melo L |
x
|
x
|
x
|
x
|
| Pepino |
Cucumis
sativus L. |
–
|
–
|
–
|
x
|
| Calabaza |
Cucurbita
pepo L. |
–
|
–
|
–
|
x
|
| Sandía |
Citrullus
vulgaris L. |
x
|
x
|
–
|
x
|
| Acelga |
Beta
vulgaris L. |
–
|
x
|
x
|
x
|
| Espinaca |
Spinacea
oleracea L. |
–
|
–
|
x
|
x
|
| Lechuga |
Lactuca
sativa L. |
x
|
x
|
x
|
x
|
| Apio |
Apium
graveolens L. |
–
|
–
|
x
|
x
|
| Zanahoria |
Daucus
carota L. |
–
|
–
|
x
|
x
|
|
 Tabla VII. Himenópteros parasitoides que afectan
(x) a las
Tabla VII. Himenópteros parasitoides que afectan
(x) a las
cuatro especies de minadores de hoja en todo el mundo
|
L.
bryoniae
|
L.
strigata
|
L.
huidobrensis
|
L.
trifolii
|
| Braconidae |
Dacnusa
hospita (Föster) |
x
|
–
|
–
|
–
|
|
Dacnusa
discolor (Föster) |
–
|
x
|
–
|
–
|
|
Dacnusa
maculipes Thomson |
x
|
x
|
–
|
–
|
|
Dacnusa
sibirica Telenga |
x
|
x
|
–
|
–
|
|
Chorebus
daimenes (Nixon) |
x
|
x
|
–
|
–
|
|
Chorebus
ampliator (Nees Esen.) |
–
|
x
|
–
|
–
|
|
Chorebus
artemisiellus Griffiths |
–
|
x
|
–
|
–
|
|
Chorebus
misellas (Marshall) |
x
|
–
|
–
|
–
|
|
Oenonogastra
microrhopalae (As.) |
x
|
–
|
–
|
–
|
|
Aphidius
ervi Hal. |
x
|
–
|
–
|
–
|
|
Aphidius
sp. |
–
|
–
|
–
|
x
|
|
Mirzagrammosoma
lineaticeps (G.) |
x
|
–
|
–
|
–
|
|
Opius
bruneipes Gahan |
–
|
–
|
–
|
x
|
|
Opius
concolor Szèpligeti |
x
|
–
|
–
|
–
|
|
Opius
dimidiatus (Ashmead) |
x
|
–
|
–
|
–
|
|
Opius
pallipes Wesm. |
x
|
x
|
–
|
–
|
|
Opius
propodealis Fischer |
–
|
x
|
–
|
–
|
|
Opius
pulchiventris Fischer |
–
|
x
|
–
|
–
|
|
Opius
levis Wesm. |
–
|
x
|
–
|
–
|
|
Opius
exiguus Wesm. |
–
|
x
|
–
|
–
|
|
Opius
dissitus Muesebeck |
–
|
–
|
–
|
x
|
|
Opius
scabriventris |
–
|
–
|
x
|
–
|
|
Opius
sp. |
–
|
–
|
x
|
x
|
|
Mesopora
sp. |
–
|
–
|
x
|
–
|
| Eulophidae |
Chrysosacris
pubicornis (Zett.) |
x
|
x
|
–
|
–
|
|
Chrysosacris
albicans Del. |
–
|
x
|
–
|
–
|
|
Chrysosacris
ainsliei Crawford |
–
|
–
|
x
|
–
|
|
Chrysosacris
pentheus (Walker) |
x
|
–
|
–
|
–
|
|
Chrysosacris
caribea Crawford |
x
|
–
|
–
|
–
|
|
Chrysosacris
parksi Crawford |
x
|
–
|
–
|
x
|
|
Chrysosacris
sp. |
–
|
–
|
–
|
x
|
|
Cirrospilus
vittatus (Walker) |
–
|
–
|
–
|
x
|
| Eulophidae |
Chrysonotomyia
punctiventris (Cr.) |
x
|
–
|
–
|
–
|
|
Chrysonotomyia
okazakii |
x
|
–
|
–
|
–
|
|
Chrysonotomyia
formosa (Wst.) |
x
|
x
|
–
|
x
|
|
Diglyphus
chabrias (Walker) |
x
|
–
|
–
|
x
|
|
Diglyphus
isaea (Walker) |
x
|
–
|
–
|
x
|
|
Diglyphus
minoeus (Walker) |
x
|
–
|
–
|
x
|
|
Diglyphus
websteri (Crawford) |
x
|
–
|
–
|
–
|
|
Diglyphus
pulchripes (Crawford) |
x
|
–
|
–
|
x
|
|
Diglyphus
crassinervis Erdös |
x
|
–
|
–
|
–
|
|
Diglyphus
poppoea (Walker) |
x
|
–
|
–
|
–
|
|
Diglyphus
albiscapus |
x
|
–
|
–
|
–
|
|
Diglyphus
intermedius (Girault) |
x
|
–
|
–
|
x
|
|
Diglyphus
begini (Ashmead) |
x
|
–
|
–
|
x
|
|
Hemiptarsenus
zilahisebessi Erd. |
x
|
–
|
–
|
x
|
|
Hemiptarsenus
varicornis |
x
|
–
|
–
|
x
|
|
Hemiptarsenus
dropion (Walker) |
x
|
–
|
–
|
–
|
|
Hemiptarsenus
zanglerii (Walker) |
x
|
–
|
–
|
–
|
|
Hemiptarsenus
semialbiclava Gir. |
x
|
–
|
–
|
x
|
|
Pediobius
acantha (Walker) |
x
|
x
|
–
|
–
|
|
Derostenus
agromyzae |
–
|
–
|
–
|
x
|
|
Derostenus
sp. |
–
|
–
|
–
|
x
|
|
Clostocerus
purpureus (Howard) |
x
|
–
|
–
|
–
|
|
Clostocerus
cinctipennis Ashmead |
x
|
–
|
–
|
x
|
|
Euparacrias
phytomyzae |
–
|
–
|
x
|
–
|
|
Diaulinopsis
callichroma Crawford |
x
|
–
|
–
|
–
|
|
Ratzeburgiola
incompleta Boucek |
x
|
–
|
–
|
–
|
|
Pnigalio
soemius (Walker) |
x
|
–
|
–
|
–
|
|
Zagrammosoma
latilineatum Ubaid. |
–
|
–
|
x
|
–
|
| Cynipoidea |
Charips
sp. |
x
|
–
|
–
|
–
|
|
Ganaspidium
spp. |
–
|
–
|
x
|
–
|
| Chalcididae |
Solenotus
intermedius (Girault) |
–
|
–
|
x
|
–
|
|
Solenotus
begini (Ashmead) |
–
|
–
|
x
|
–
|
| Pteromalidae |
Halticoptera
smaragdina (Curtis) |
–
|
x
|
–
|
–
|
|
Halticoptera
aenea (Walker) |
–
|
–
|
x
|
–
|
|
Halticoptera
patellana (Dalman) |
x
|
–
|
x
|
x
|
|
Halticoptera
circullus (Walker) |
x
|
–
|
x
|
–
|
|
Halticoptera
crius (Walker) |
x
|
–
|
–
|
–
|
|
Cyrtogaster
vulgaris Walker |
x
|
–
|
–
|
–
|
|
Lamprotatus
tubero Walker |
–
|
–
|
x
|
–
|
| Entedontidae |
Euparacrias
phytomyzae (Bréthes) |
–
|
–
|
x
|
–
|
|
 Tabla VIII. Insecticidas autorizados para el control de
Liriomyza en
Tabla VIII. Insecticidas autorizados para el control de
Liriomyza en
plantas hortícolas. (Delegación de Agricultura
y Pesca de Almería, 2002)
| Formulado |
Cultivo
|
Plazo
Seg. Días
|
| ABAMECTINA
1,8% |
To,
Pi, Me.
|
3
|
| ABAMECTINA
3,37% |
To,
Pi, Me.
|
3
|
| ACEITE
VERANO 75% |
To,
Ca, Pe.
|
10
|
| ACEITE
VERANO 85% |
To,
Ca, Pe.
|
10
|
| CIROMAZINA
75% |
To,
Pi, Me, San, Ju.
|
3
|
| DIAZINON
40% WP |
To,
Pi, Be.
|
30
|
| DIAZINON
60% EC |
To,
Pi, Be.
|
30
|
| DIAZINON
60% EW |
To,
Pi, Be.
|
30
|
| OXAMILO
10%GR |
To,
Me, Pi, Be.
|
30
|
| OXAMILO
10%SL |
To,
Me, Pi, Be.
|
3
|
|
|
|
|
______
To: tomate, Pi: pimiento, Ca: calabacín, Pe: pepino,
Me: melón, San: sandía, Be: berenjena, Ju:
judía
 Tabla IX. Duración media de los estados de
L.trifolii
Tabla IX. Duración media de los estados de
L.trifolii
a diferentes temperaturas en apio (LEIBEE, 1984)
|
JUDIA
|
PEPINO
|
SANDÍA
|
BERENJENA
|
TOMATE
|
CALABACÍN
|
MELÓN
|
| AZADIRACTIN |
X
|
X
|
X
|
X
|
4a(1,5)
|
X
|
X
|
| CIROMAZINA |
X
|
X
|
X
|
X
|
X
|
X
|
X
|
| ABAMECTINA |
|
4+5
|
2+3+4
|
|
3+4a(2)+5
|
2+3+4
|
3+5
|
| OXAMILO |
|
|
|
2+6
|
|
|
|
| DELTAMETRIN |
|
|
|
|
|
|
3+5
|
|
________
(X)
Autorizada
Restricciones de uso:
(1) No realizar más de un tratamiento por campaña.
(2) No realizar más de dos tratamientos por campaña.
(3) En caso de presencia de abejas, para su protección,
tener en cuenta la clasificación toxicológica
del formulado a emplear:- Peligrosidad controlable para abejas
(tapar las colmenas previamente al tratamiento y mantenerlas
así durante 1 ó 2 horas más tarde).-
Relativamente poco peligroso para abejas (tratar en las horas
en que no estén presentes: atardecer y amanecer).-
Muy peligroso para abejas (no tratar en áreas ni épocas
de actividad de las mismas).
(4) Utilizar sólo con presencia de amarilleamiento
de etiología viral.
(5) Utilizar sólo cuando las materias activas permitidas
sin restricciones no hayan sido efectivas.
(6) Sólo en tratamientos localizados
|
.... |