Métodos de muestreo para insectos saproxílicos
Las razones para la captura de insectos saproxilófagos pueden ser muy diversas pero hay dos principalmente interesantes desde un punto de vista ecológico: (1) la realización de inventarios faunísticos y (2) la cuantificación y comparación de la diversidad de saproxilófagos entre puntos de muestreo diferentes.
El programa de muestreo.- El programa de muestreo especifica el tamaño y número de las unidades muestrales y la disposición espacial y temporal de las muestras, de modo que puedan lograrse los objetivos establecidos más arriba. El programa de muestreo debe diseñarse de modo cuidadoso. Es recomendable consultar Krebs (1989), Sutherland (1996), Hayek & Buzas (1997), New (1998) y Leather & Watt (2005) para más información sobre este importante aspecto.
Las técnicas de muestreo.- Las técnicas de muestreo son los procedimientos (equipo y modo en que se hace el recuento) utilizados para recoger la información en una unidad de muestreo dada. Hay numerosas obras que describen técnicas de captura de insectos (Ausden, 1996; New, 1998; Southwood & Henderson, 2000; Leather, 2005). A continuación se ofrece una lista y descripción de los principales métodos de muestreo empleados para insectos saproxílicos en bosques templados. Métodos aplicables en bosques tropicales se describen en algunos capítulos de Leather (2005).
(1) Muestreo
directo.- Consiste en la búsqueda directa, a vista, de
insectos en los hábitats que ocupan. Además de ejemplares
adultos y de restos (élitros, etc.) que pueden ser identificables,
muchas veces este método proporciona larvas que tienen que ser
criadas hasta el estado adulto para poder ser identificadas. Sus ventajas
son que permite encontrar especies que escapan a otros métodos
de muestreo y que permite establecer una relación directa entre
la especie encontrada y su hábitat (Barbalat, 1995). Sin embargo,
no permite cuantificar fácilmente el esfuerzo de muestreo realizado
(Barbalat, 1995). Además es muy destructivo y no permite el muestreo
completo del interior de troncos (Økland, 1996). Por ello es
más adecuado dentro de programas de muestreo destinados a hacer
inventarios faunísticos detallados, pero no cuando lo que se
pretende es la comparación entre puntos de muestreo.
Variantes:
1. A. Muestreo directo de madera muerta.
1. B. Muestreo directo de cuerpos fructíferos de hongos.
1. C. Pelado de corteza.
(2) Trampas
de emergencia.- Consisten en el confinamiento, dentro de una
"tienda" o un recipiente, de trozos de madera muerta u hongos,
de modo que los insectos que emergen de dichos sustratos quedan retenidos
y pueden ser recogidos y determinados. Su ventaja es que permiten una
asociación directa entre la especie recogida y su hábitat.
No obstante, son difíciles de estandarizar y muchas de las especies
se producen en cantidades demasiado bajas para cualquier análisis
estadístico (Økland, 1996).
Variantes:
2. A. En el laboratorio.- Trozos de madera muerta de distinto tamaño,
así como cuerpos fructíferos de hongos, pueden mantenerse
en distintos tipos de envases (cajas de cartón tipo detergente,
tetra-briks de leche usados, cajones fabricados ex profeso, ...). A
estos envases se les añade un depósito transparente, situado
en la parte superior y/o lateral, donde los insectos emergidos son atraídos
al ser la única parte iluminada. Las condiciones de laboratorio
(temperatura, humedad) no tienen por qué semejar las naturales
y eso puede afectar a los resultados.
2. B. En el campo.- Tocones, troncos caídos o trozos de troncos
o ramas apilados ex profeso pueden cubrirse con una tienda. Los diseños
varían mucho (Fig. 1), desde tiendas de tela en las cuales se
coloca madera previamente cortada en trozos de tamaño adecuado
(Owen, 1989, 1992; Grove, 2000), o tiendas que cubren troncos (o parte
de los mismos) caídos de modo natural (Yee et al., 2001).
A)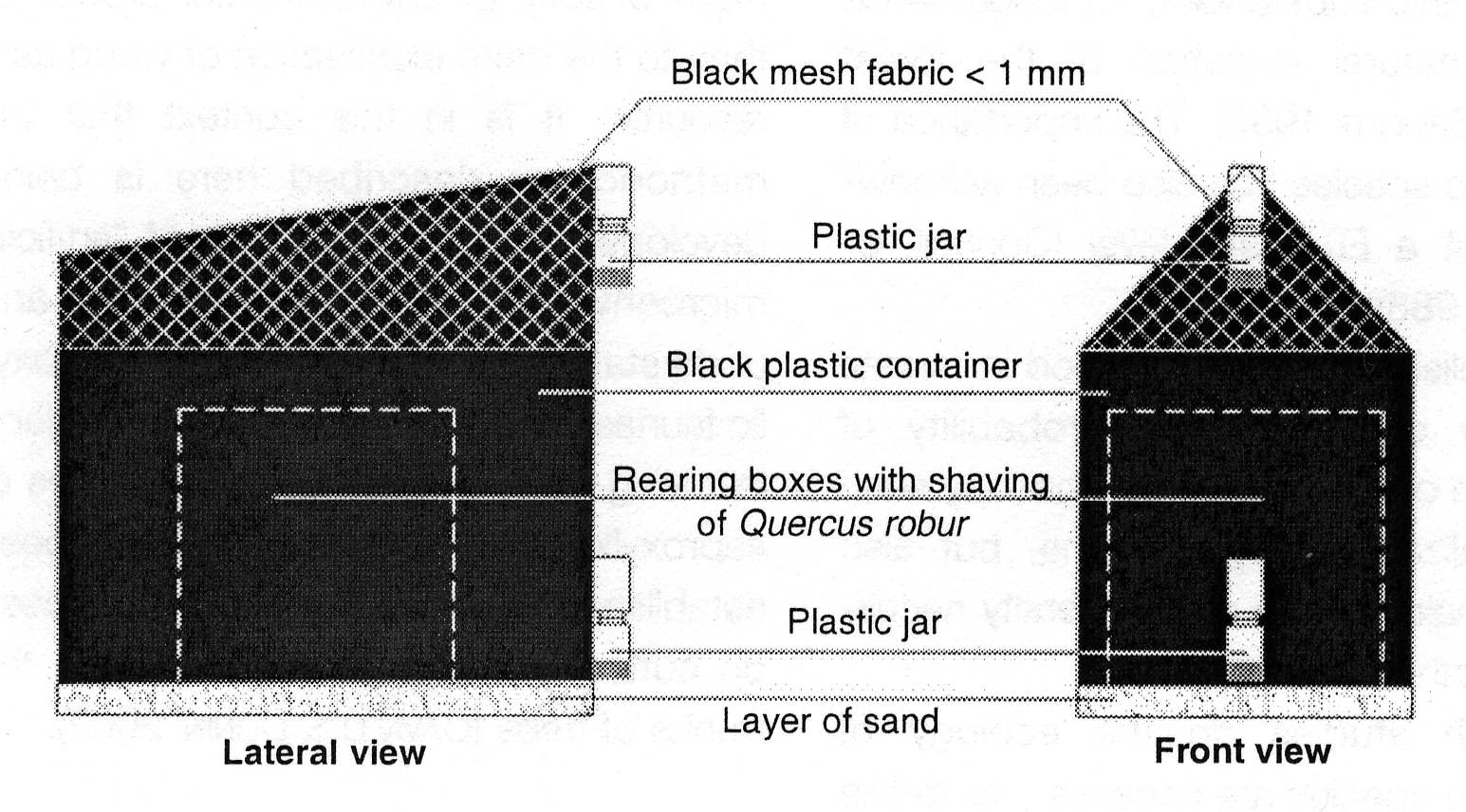
B)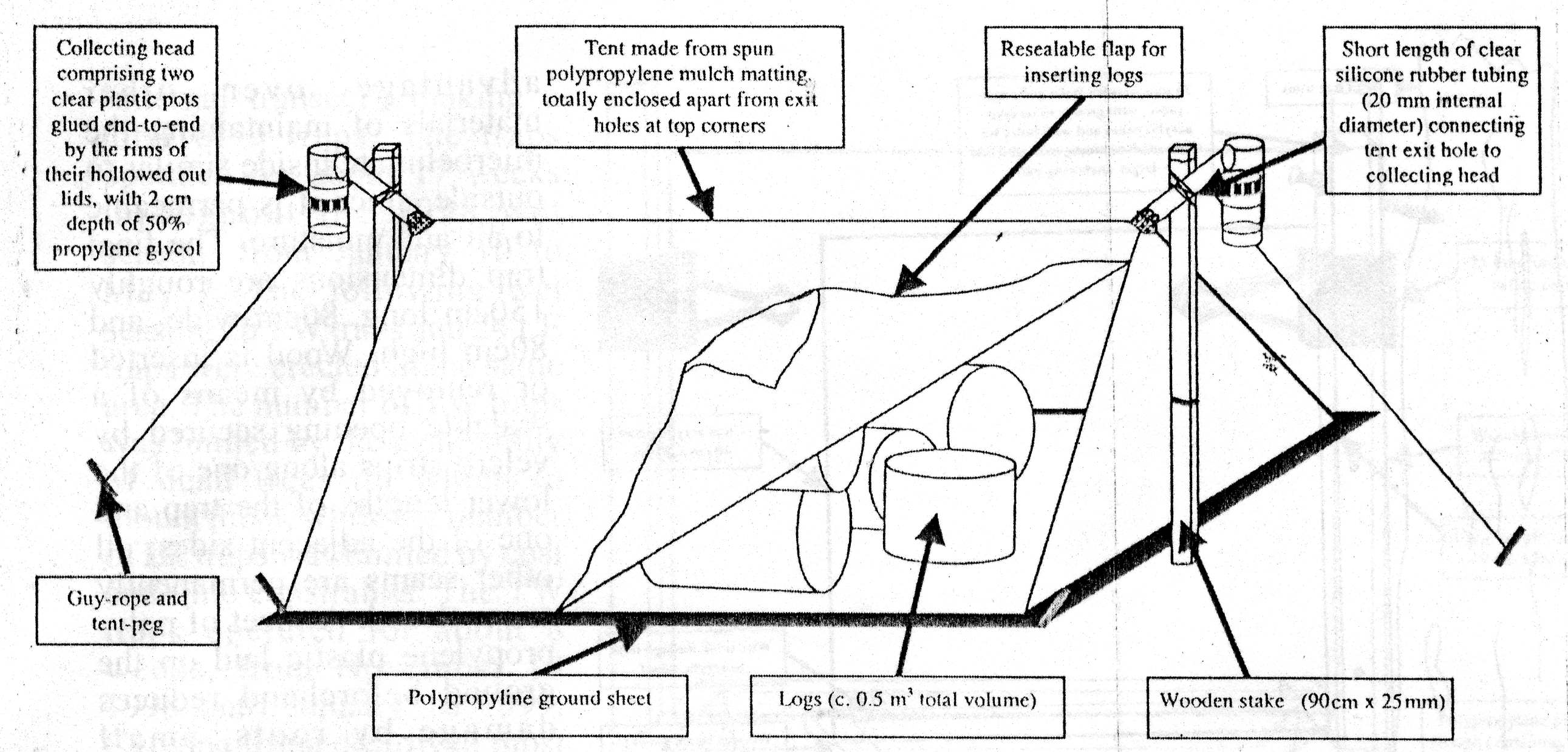
C)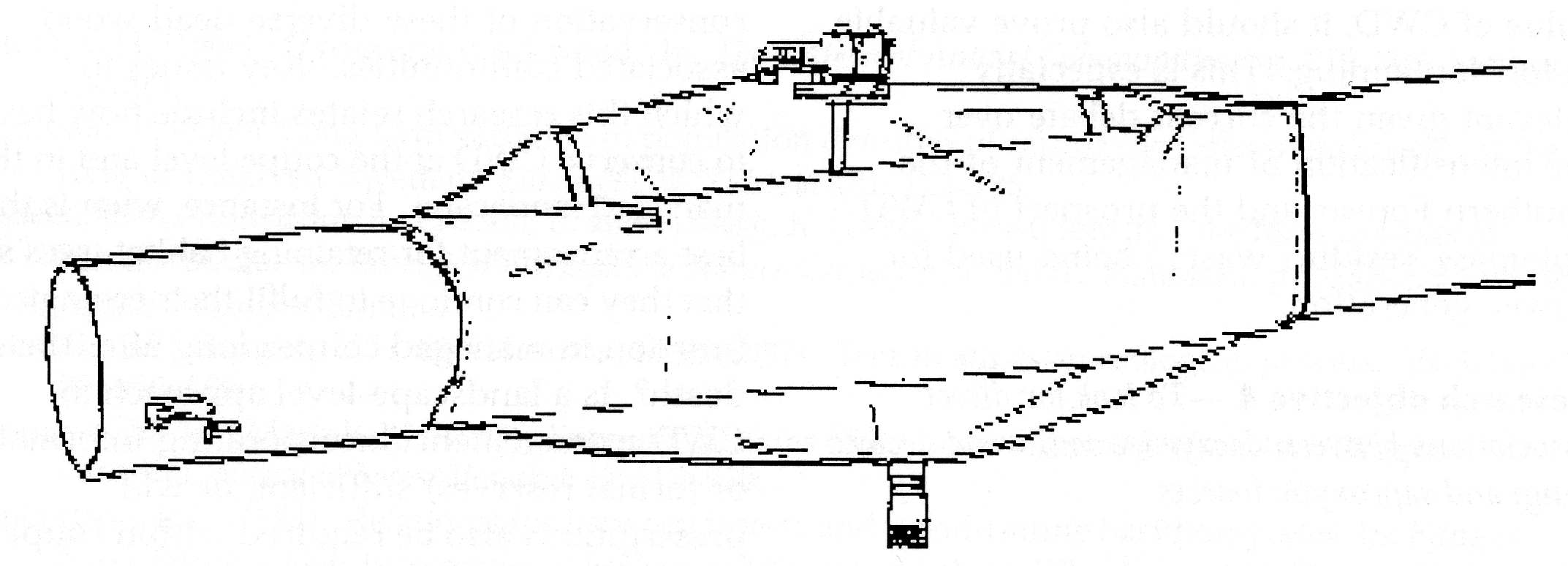
Fig. 1. Distintos diseños de trampas de emergencia. A) Cajón (tomado de Birtele, 2003). B) Tienda (tomado de Grove, 2000). C) Trozo de tronco envuelto en una trampa de emergencia (tomado de Yee et al., 1999).
(3) Extracción.- Para organismos muy pequeños como ácaros, pueden tomarse trozos de madera y someterse a extracción por calor o por flotación.
(4) Trampas
invisibles de captura en vuelo.- También llamadas "trampas
de interceptación" o "trampas ventana". Consisten
en la colocación de algún tipo de panel transparente con
el cual chocan los insectos en vuelo. Esos insectos son recogidos en
un recipiente colocado en la parte inferior del panel. Una variante
utiliza dos paneles transparentes, cruzados entre sí a modo de
aspa. Este tipo de trampa no da información directa sobre el
microhábitat de desarrollo larvario (a diferencia del muestreo
directo o las trampas de emergencia) pero es más eficiente como
método de muestreo y de cara a la comparación de sitios
de muestreo (Økland, 1996).
Variantes:
4. A. Trampas libres.- Se sitúan suspendidas entre dos árboles
o estacas (Chapman & Kinhorn, 1955; Økland 1996; Grove, 2000)
(Fig. 3). Por su colocación, es susceptible de capturar insectos
que no son estrictamente saproxílicos.
4. B. Trampas
junto a troncos.- Se clavan o atan a troncos muertos en pie (Grove,
2000) o a cuerpos fructíferos de hongos (Kaila, 1993) (Fig. 2).
De ese modo aumenta la especificidad de la trampa por insectos saproxílicos.
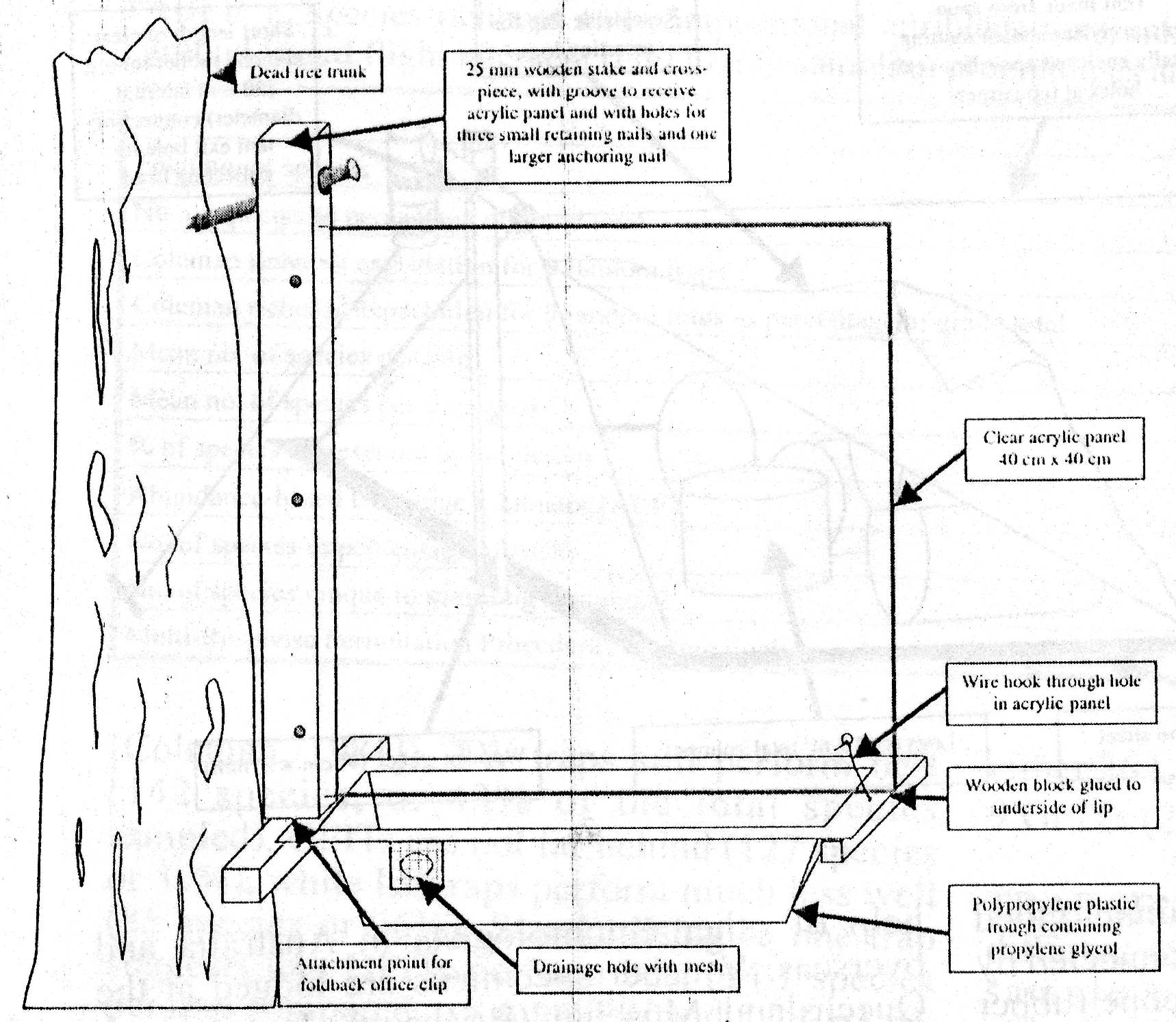
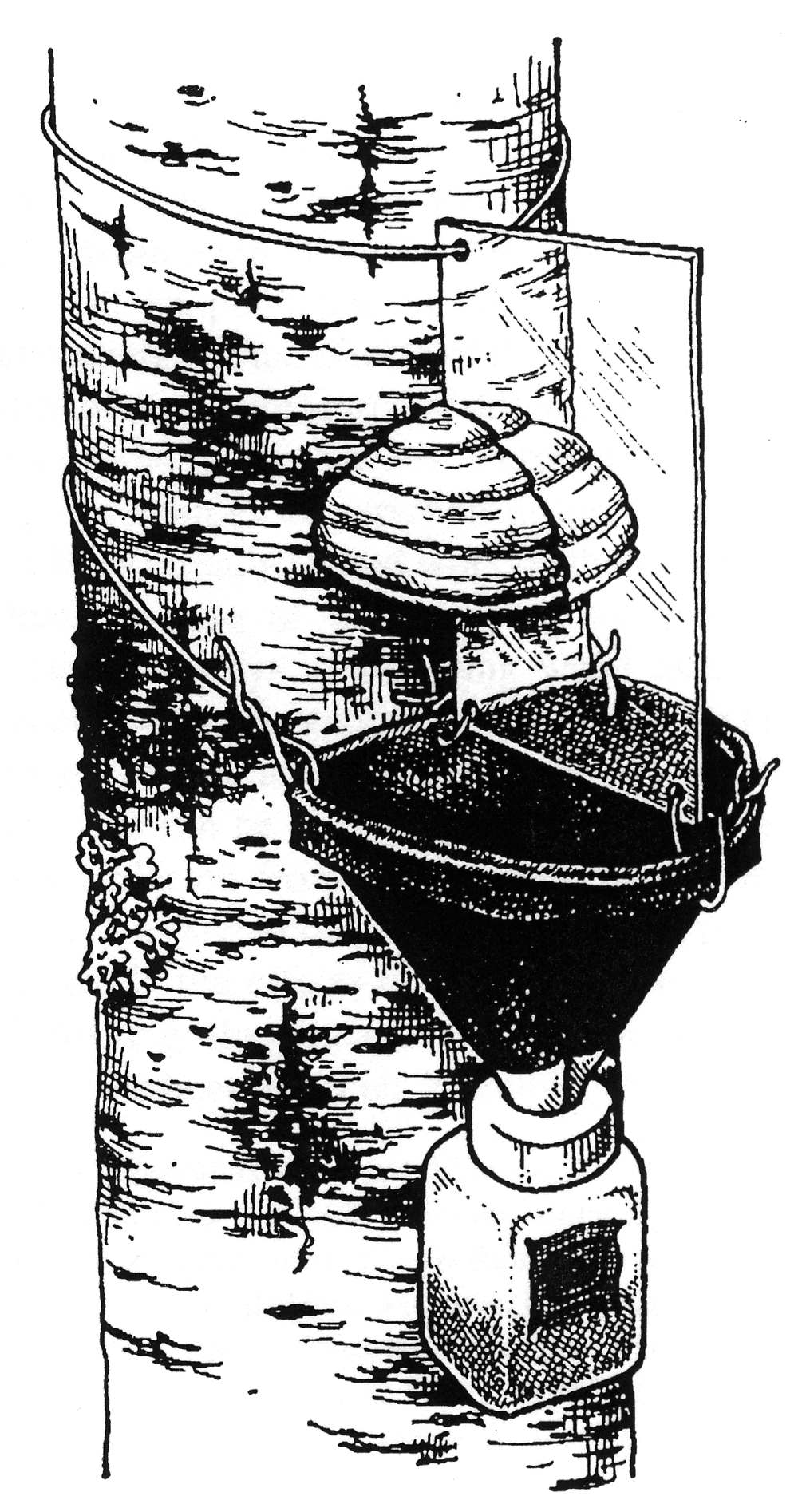
Fig. 2. Dos tipos de de trampa ventana unida a troncos. Izquierda, tomado de Grove (2000); derecha tomado de Kaila (1993).
(5) Trampas
visibles de captura en vuelo.- El principio de funcionamiento
es similar al de las trampas invisibles o trampas ventana, pero en lugar
de utilizar una superficie invisible emplean una superficie visible
para los insectos, pero en la cual no logran aterrizar adecuadamente
tras el choque con la misma.
Variantes:
5. A. Trampas de Lindgren o multiembudo.- Consisten en una columna formada
por embudos de plástico negro que se cuelga de una rama o de
una estaca (Lindgren, 1983). Posee una tapadera superior para protegerla
de la lluvia, y un recipiente de recogida inferior.
5. B. Trampas Malaise (Fig. 3).- Consisten en una especie de tienda
con un panel vertical de color negro, provisto de dos paredes laterales
y cubierto por un tejadillo. Los insectos en vuelo chocan contra el
panel y, desviados por las paredes laterales, tienden a volar hacia
arriba y terminan en el tejadillo, que a modo de embudo los dirige hacie
un recipiente recoletor en un vértice del tejadillo. Versiones
mini de la trampa Malaise se pueden colocar en las copas de los árboles
(Barbalat, 1995). Peck & Davies (1980) presentan una variante de
muy bajo presupuesto, consistente en una Trampa Malaise sin tejadillo
ni lados, o una tela que haga una función similar, extendida
entre dos árboles y con un recipiente recolector en la parte
inferior. Esta variante hace de híbrido, de gran tamaño,
entre una trampa visible y una trampa ventana.
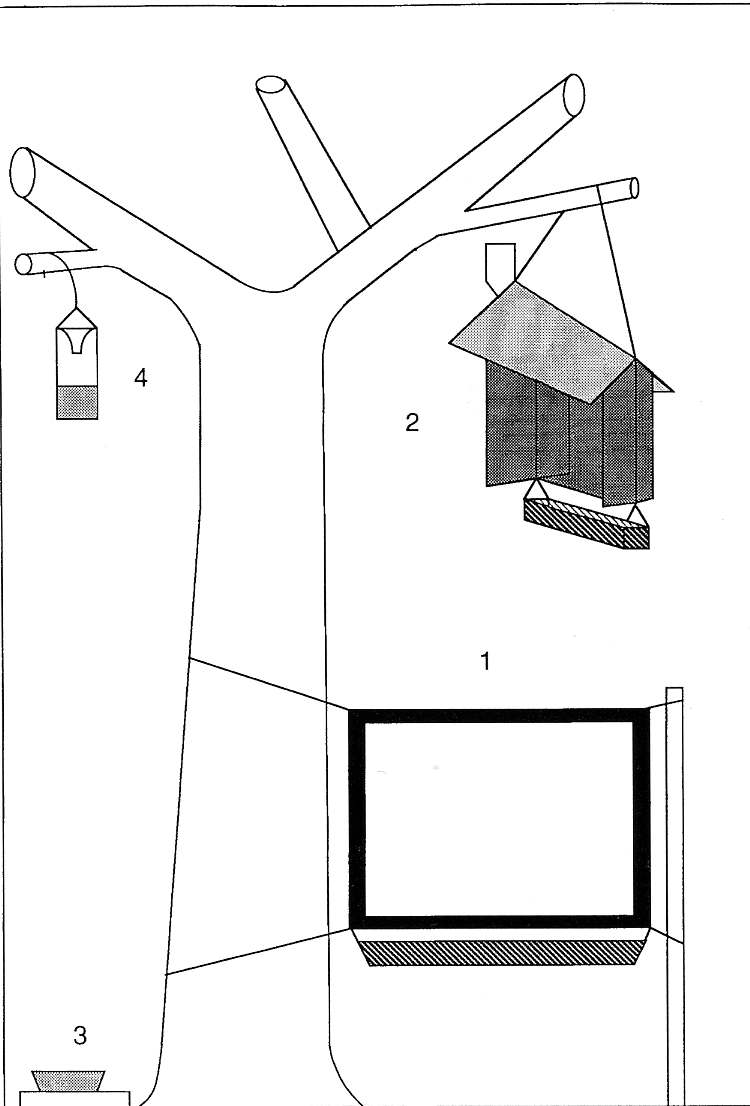
Fig. 3. Conjunto de trampas en una localidad de muestreo. 1) Trampa ventana libre. 2) Mini-trampa Malaise. 3) Plato de color. 4) Trampa con cebo (tomado de Barbalat, 1995).
(6) Trampas con cebo.- Estas trampas, de variada morfología, se basan en un cebo atrayente que se sitúa sobre o dentro de un recipiente en el cual quedan atrapados los insectos. En función de la naturaleza del cebo se verán atraídas unas u otras especies.
Variantes:
6. A. Trampas con feromonas.- Específicas para especies concretas.
Normalmente se han desarrollado feromonas sintéticas para la
atracción de especies plaga forestales, por lo cual no muy útiles
para estudios de diversidad sino para estudios de entomología
aplicada.
6. B. Platos de colores.- Consisten en platos de color blanco o amarillo,
normalmente llenos de agua. Estos platos se sitúan sobre el suelo
o sobre un poste. Los insectos atraídos quedan capturados en
el agua del plato. Atraen a las especies florícolas (Barbalat,
1995) (Fig. 3).
6. C. Trampas
con vino, cerveza, zumo, etc.- Se trata de botellas u otro tipo
de recipientes que se cuelgan de ramas y se llenan parcialmente con
el cebo (Allemand & Aberlenc, 1991) (Fig. 3). El propio líquido
de cebo es el que atrapa a los insectos atraídos. Atraen a las
especies sapívoras (Barbalat, 1995). El etanol atrae principalmente
a especies pioneras en la descomposción de madera u hongos (Jonsell
et al., 2003). Este tipo de trampas es fácilmente adaptable de
modo que capturen a los insectos vivos y de ese modo poder realizar
estudios de captura, marcaje y recaptura (Allemand & Aberlenc, 1991).
(7) Trampas pegajosas.- Consisten en recubrir varios tipos de sustrato, natural (corteza) o artificial (Plexiglas, malla metálica, cartón, cristal), cubierto de pegamento comercial no secable tipo Tanglefoot o similar. Las superficies pueden ser planas (Younan & Hain, 1982) o cilíndricas (trozos de tubería negra; Chénier & Philogène, 1989).
(8) Trampas de luz.- Consisten en una sábana o pieza de tela blanca dispuesta verticalmente, junto a la cual se coloca una fuente de luz que atrae a los insectos. Normalmente se usan tres puntos de luz, uno a cada lado de la sábana y un tercero más alto que se utiliza como atrayente a larga distancia.
(9) Trampas
combinadas.- Combinan algunas de las trampas anteriores.
Variantes:
9. A. Combi-trampas.- Combinan las trampas 4A con las 6B, mediante un
panel transparente del cual se cuelga un embudo de color amarillo lleno
de agua con conservante (Moretti & Barbalat, 2004).
9. B. Cebado de trampas visibles o invisibles de captura en vuelo.
Eficacia
de los muestreos
Martikainen (2003) expone que las especies comunes son fácilmente
registradas con estos tipos de muestreo y aparecen, por lo general,
dentro de los dos primeros años de muestreo. Sin embargo, las
especies más raras pueden no aparecer incluso en 10 años
de muestreo. Según Martikainen (2003), para garantizar la presencia
de especies raras en la muestra se requieren tamaños de muestra
grandes, superiores a 2000 individuos y 200 especies. Las trampas ventana
junto a troncos son mucho más eficaces que las trampas ventana
libres. La búsqueda directa también es muy eficaz en la
detección de especies raras.
Estas recomendaciones son al menos válidas para bosques boreales
europeos.
Eficiencia
relativa de los tipos de trampas
Ha habido diversos trabajos de comparación de la eficiencia de
captura de trampas. Por lo general, las trampas invisibles de captura
en vuelo han sido las más contrastadas contra otros tipos de
trampa, aunque en general nunca se han comparado más de 4 tipos
diferentes de modo simultáneo.
Las principales conclusiones de estas comparaciones son:
(1) Cada tipo
de trampa captura un espectro diferente de insectos saproxílicos,
con solapamiento sólo parcial de las especies muestradas (Younan
& Hain, 1982; Økland, 1996; Hammond, 1997; Grove, 2000).
(2) Casi invariablemente,
las trampas invisibles de captura en vuelo son más eficaces (capturan
más especies diferentes) que las otras alternativas comparadas:
trampas de emergencia (Økland, 1996; Grove, 2000); platos de
colores (Barbalat, 1995); trampas con cerveza (Barbalat, 1995); trampas
Malaise (Barbalat, 1995); pelado de corteza (Siitonen, 1994).
(3) La excepción
la constituyen las trampas pegajosas. En el caso de Younan & Hain
(1982), fueron más eficientes que las trampas invisibles de captura
en vuelo para el muestreo de Diptera e Hymenoptera (pero no para el
de Coleoptera). En el caso de Chénier & Philogène
(1989), las tuberías de estufa pegajosas fueron más eficientes
que las trampas invisibles de captura en vuelo. Las trampas multiembudo
también fueron más eficaces que las trampas ventana en
la única comparación disponible (Chénier &
Philogène, 1989).
(4) La comparación entre trampas libres y trampas pegadas a troncos no da resultados consistentes (Økland, 1996; Grove, 2000). La adición de cebos aumenta su rendimiento (Jonsell & Nordlander, 1995).
Trampas eficaces
para Lucanidae
Desafortunadamente, existe muy poca información sobre el tipo
de trampa más adecuado para el muestreo de Lucanidae. En estudios
fuera de Europa, se ha capturado Lucanidae con trampas ventana (Hammond,
1997; Grove, 2000). En Europa, se han capturado Lucanidae con trampas
ventana (Kaila et al., 1994: dos especies no detalladas; Barbalat, 1995:
Sinodendron; Similä et al., 2003: Ceruchus), mini-trampas
Malaise suspendidas en copas de árbol (Barbalat, 1995: Platycerus
caprea), platos coloreados (Barbalat, 1995: Platycerus caraboides),
y trampas con cebo (Allemand & Aberlenc, 1991: Dorcus, Lucanus).
En general, los números capturados fueron muy bajos y no permiten
evaluar adecuadamente la eficiencia de las trampas.
Las trampas de luz son eficaces para la captura de Pseudolucanus pero su utilidad para capturar Lucanus ha sido objeto de controversia. Al parecer, la razón de las discrepancias entre entomólogos acerca de la eficacia de las trampas de luz por lo que atañe a Lucanus es el tipo de lámpara. Las lámparas con luz negra son ineficaces, pero las que utilizan vapor de mercurio sí son eficaces.
Referencias
Allemand, R.; Aberlenc, H.-P. 1991. Une méthode efficace d'échantillonnage
de l'entomofaune des frondaisons: le piège attractif aérien.
Bull. Soc. ent. Suisse 64: 293-305.
Ausden,
M. 1996. Invertebrates. En: Sutherland, W. J. (ed.) Ecological census
techniques: a handbook: 139-177. Cambridge University Press, Cambridge.
Barbalat,
S. 1995. Efficacité comparée de quelques méthodes
de piégeage sur certains coléopteres et influence de l'antophilie
sur le résultat des captures. Bulletin de la Societé
neuchâteloise des Sciences naturelles 118: 39-52.
Birtele,
D. 2003. The succession of saproxylic insects in dead wood: a new research
method.
En: Mason, F.; Nardi, G.; Tisato, M. (eds.) Proceedings of the International
Symposium "Dead wood: a key to biodiversity", Mantova,
May 29-31 2003: 91-93. Sherwood 95, Suppl. 2.
Chapman,
J. A.; Kinghorn, J. M. 1955. Window flight traps for insects. Can.
Ent. 87: 46-47.
Chénier,
J. V. R.; Philogène, B. J. R. 1989. Evaluation of three trap
designs for the capture of conifer-feeding beetles and other forest
Coleoptera. Can. Ent. 121: 159-167.
Grove,
S. J. 2000. Trunk window trapping: an effective technique for sampling
tropical saproxylic beetles. Mem. Queensland Mus. 46: 149-160.
Hammond, H. E. J. 1997. Arthropod biodiversity from Populus coarse woody material in Nort-central Alberta: a review of taxa and collection methods. Can. Ent. 129: 1009-1033.
Hayek, L.-A.; Buzas, M. A. 1997. Surveying natural populations. Columbia University Press, New York.
Jonsell,
M.; Nordlander, G. 1995. Field attraction of Coleoptera to odours of
the wood-decaying polypores Fomitopsis pinicola and Fomes
fomentarius. Ann. Zool. Fennici 32: 391-402.
Jonsell,
M.; Schroeder, M.; Larsson, T. 2003. The saproxylic beetle Bolitophagus
reticulatus: its frequency in managed forests, attraction to volatiles
and flight period. Ecography 26: 421-428.
Kaila,
L. 1993. A new method for collecting quantitative samples of insects
associated with decaying wood or wood fungi. Entomol. Fenn. 4:
21-23.
Kaila, L.; Martikainen, P.; Punttila, P.; Yakovlev, E. 1994. Saproxylic beetles (Coleoptera) on dead birch trunks decayed by different polypore species. Ann. Zool. Fennici 31: 97-107.
Krebs,
J. R. 1989. Ecological methodology. HarperCollins, New York.
Leather,
S. (ed.). Insect sampling in forest ecosystems. Blackwell, Malden,
MA.
Leather,
S. R.; Watt, A. D. 2005. Sampling theory and practice. En: Leather,
S. R. (ed.) Insect sampling in forest ecosystems: 1-15. Blackwell,
Malden, MA.
Lindgren,
B. S. 1983. A multiple funnel trap for scolytid beetles (Coleoptera).
Can. Ent. 115: 299-302.
Martikainen,
P. 2003. Saproxylic beetles in boreal forests: temporal variability
and representativeness of samples in beetle inventories. En: Mason,
F.; Nardi, G.; Tisato, M. (eds.) Proceedings of the International
Symposium "Dead wood: a key to biodiversity", Mantova,
May 29-31 2003: 83-85. Sherwood 95, Suppl. 2.
Moretti,
M.; Barbalat, S. 2004. The effects of wildfires on wood-eating beetles
in deciduous forests on the southern slope of the Swiss Alps. Forest
Ecol. Manag. 187: 85-103.
New,
T. R. 1998. Invertebrate surveys for conservation. Oxford University
Press, Oxford.
Økland,
B. 1996. A comparison of three methods of trapping saproxylic beetles.
Eur. J. Entomol. 93: 195-209.
Owen,
J. A. 1989. An emergence trap for insects breeding in dead wood. Br.
J. Ent. Nat. Hist. 2: 65-67.
Owen,
J. A. 1992. Experience with an emergence trap for insects breeding in
dead wood. Br. J. Ent. Nat. Hist. 5: 17-20.
Peck,
S. B.; Davies, A. E. 1980. Collecting small beetles with large-area
"window" traps. Coleopt. Bull. 34: 237-239.
Siitonen,
J. 1994. Decaying wood and saproxylic Coleoptera in two old spruce forests:
a comparison based on two sampling methods. Ann. Zool. Fennici
31: 89-95.
Similä,
M.; Kouki, J.; Martikainen, P. 2003. Saproxylic beetles in managed and
seminatural Scots pine forests: quality of dead wood matters. Forest
Ecol. Manag. 174: 365-381.
Southwood,
T. R. E.; Henderson, P. A. 2000. Ecological methods. 3ª
ed. Blackwell Science, Oxford.
Sutherland,
W. J. (ed.). 1996. Ecological census techniques: a handbook.
Cambridge University Press, Cambridge.
Yee,
M.; Yuan, Z.-Q.; Mohammed, C. 2001. Not just waste wood: decaying logs
as key habitats in Tasmania's wet sclerophyll Eucalyptus obliqua
production forests: the ecology of large and small logs compared. Tasforests
13: 119-128.
Younan, E. G.; Hain, F. P. 1982. Evaluation of five trap designs for sampling insects associated with severed pines. Can. Ent. 114: 789-796.