Aracnet 7 -Bol. S.E.A., nº 28 (2001) : 35—48.
Artículo
Ecología de los Colémbolos (Hexapoda, Collembola) en Los Monegros (Zaragoza, España)*
Javier I. Arbea 1 y Javier Blasco-Zumeta 2
1 Departamento de Ciencias Naturales. I.E.S. Alhama. Avda. del Villar, 44. 31591 Corella (Navarra) jarbea@jet.es
2 C/. Hispanidad, 8. 50750 Pina de Ebro (Zaragoza). blaszu@arrakis.es
* Conferencia presentada en el IX Congreso Ibérico de Entomología, Zaragoza, julio 2000
Resumen: Con el fin de profundizar en la ecología de los microartrópodos en los Monegros se han estudiado las poblaciones de colémbolos edáficos bajo 22 especies vegetales representativas de los diferentes tipos de comunidades vegetales presentes en esta zona, que podemos agrupar en cuatro clases fitosociológicas: Quercetea ilicis Br.-Bl., 1947, Ononido-Rosmarinetea Br.-Bl., 1947, Lygeo-Stipetea Rivas Martínez, 1977 y Arthrocnemetea Br.-Bl. & R.Tx., 1943.
En estos biotopos se han realizado muestreos estacionales durante los años 1994 y 1995, encontrándose un total de 57 especies de colémbolos, de las que diez pueden considerarse representativas de la región. Estas diez especies tienen un comportamiento marcadamente xerófilo o son capaces de resistir períodos de altas temperaturas y baja humedad: tres especies son atmobias xerófilas, Entomobrya sp., Sminthurus hispanicus y Spatulosminthurus betschi; cuatro son hemiedáficas xerófilas, Xenylla brevisimilis mediterranea, Xenylla maritima, Cryptopygus thermophilus y Lepidocyrtus sp.; y tres son hemiedáficas mesófilas, Sphaeridia pumilis, que sobrevive los períodos de sequía en estado de huevo, Brachystomella parvula y Folsomides portucalensis, que son capaces de resistir períodos de sequía entrando en anhidrobiosis.
La fauna de colémbolos está dominada por los elementos hemiédaficos (54% de las especies), tanto mesófilos como xerófilos. Destaca el bajo porcentaje de especies euedáficas (18%) y la importante proporción de atmobios (28%), mayoritariamente xerófilos.
Se ha efectuado un análisis factorial de correspondencias y una clasificación jerárquica de los biotopos para determinar los agrupamientos de los mismos en función de sus perfiles faunísticos. Estos análisis nos muestran una separación neta de las poblaciones de colémbolos edáficos en las clases fitosociológicas estudiadas.
Respecto al tipo de distribución geográfica, es destacable la gran cantidad de especies con distribución restringida: 40% son endémicas; un 21% tienen una distribución europea (3 especies europeas en sentido amplio, 6 especies de Europa central y meridional y 3 especies mediterráneo-atlánticas), mientras que el resto (39%), presentan una distribución más amplia (7% paleártica, 14% holártica y 17% cosmopolita).
Ecology of soil Sprintails (Hexapoda, Collembola) in the Monegros Area (Northern Spain)
Summary: The collembological structure of the population of soil microarthropods in the Monegros Area (Northern Spain) was studied. For this purpose, soils from 22 plant species were analyzed using seasonal samples collected on the years 1994 and 1995. We can group the sampling sites in four phytosociological classes: Quercetea ilicis Br. Bl., 1947, Ononido-Rosmarinetea Br. Bl., 1947, Lygeo-Stipetea Rivas Martínez, 1977 and Arthrocnemetea Br. Bl. & R. Tx., 1943.
A total of 57 Collembolan species were found. Ten of these can be considered characteristic of the studied area, they are xerophilic species with an ability to actually survive dry periods with high temperatures. Three species in this group are xerophilic atmobious, Entomobrya sp., Sminthurus hispanicus and Spatulosminthurus betschi; four species are xerophilic hemiedaphon, Xenylla brevisimilis mediterranea, Xenylla maritima, Cryptopygus thermophilus and Lepidocyrtus sp.; and three species are mesophilic hemiedaphon, Sphaeridia pumilis, which spends the dry periods in egg stage, Brachystomella parvula and Folsomides portucalensis, both with an inactive but reversible anhydrobiotic stage during dry periods.
The Collembola fauna is mainly represented by the mesophilic or xerophilic hemiedaphic species (54 %), followed by the atmobious, largely xerophilic, species (28 %), and the euedaphic species (18 %).
Several multivariate analysis were carried out. The Correspondence Analysis and the Cluster Analysis based on Jaccard's similarity coefficient was used to examine the relationships between the different biotopes according to the Collembolan species that they contained. These analysis indicated that the distribution of Collembolan populations was related to the phytosociological type of the biotope.
In terms of their biogeographical distribution, 39 % present a large distribution (7 % Palaearctic, 14 % holoarctic and 17 % cosmopolitan), 21 % are European (three European species sensu lato, six species of Central and Southern Europe, and three species with a Mediterranean and Atlantic distribution), and 40 % are endemic of the Iberian Peninsula. Of this last group, 19 species are confined to the Ebro valley (NE Spain), and six of them have only been found solely in the "Retuerta de Pina" Area (Monegros Region), Onychiurus sp. minutus group, Proctostephanus n. sp., Seira sp., Cyphoda sp., Bourletiella sp., Fasciosminthurus spp.
I. Características generales de los colémbolos
Los colémbolos son artrópodos diminutos que, junto con los proturos y dipluros, suelen ser agrupados en los Hexapoda entognatos. Aunque actualmente no se consideran verdaderos insectos, e incluso hay quien argumenta que son más próximos a los crustáceos que a los insectos (Lawrence, 2000), se siguen agrupando con ellos por tradición. Constituyen un grupo homogéneo dentro de los Hexapoda, presentando un conjunto de caracteres que los aísla fácilmente del resto de los Hexapoda y les confiere una identidad particular entre los artrópodos primitivos: estructura del tubo digestivo y de la gónada, persistencia de un aparato excretor celómico, ausencia de tubos de Malpighi… Presentan, además, dos características únicas que los definen como grupo: un órgano saltador o furca, situado ventralmente en el cuarto segmento abdominal, y un tubo ventral en el primer segmento abdominal, relacionado con la regulación hídrica y que además puede tener funciones de órgano adhesivo.
Los colémbolos, indicadores de biodiversidad
Los colémbolos son habitantes típicos del suelo, de forma que desarrollan su ciclo biológico completo en él. Son, junto con los ácaros oribátidos, los artrópodos dominantes en el suelo, encontrándose tanto en las zonas profundas como superficiales, y tienen una gran importancia en las capas del suelo con abundante materia orgánica, tanto por su densidad como por la función que desempeñan en ellas. Al ser, dentro de la fauna edáfica, uno de los grupos más diversificados constituyen un instrumento muy eficiente para estudios de biodiversidad en hábitats edáficos (Deharveng, 1996).
Adaptaciones de los colémbolos a las distintas condiciones del medio edáfico
Los colémbolos, como un elemento más del subsistema suelo, contribuyen a su normal funcionamiento. Pueblan biotopos muy diversos y son muy sensibles a las variaciones de las condiciones ecoclimáticas, por lo que son un material excelente para estudios sinecológicos.
La humedad y la temperatura son factores determinantes del hábitat óptimo de los colémbolos, ya que influyen en la tasa de reproducción y crecimiento de los individuos y en su distribución vertical a lo largo de un perfil. En las regiones templadas, las variaciones estacionales de los factores climáticos no parecen ser determinantes de la distribución de los animales en el suelo, ya que en general no se produce la falta de disponibilidad de agua. En estas regiones, las variaciones térmicas podrían tener más importancia (Vannier, 1973). Por el contrario, en las regiones mediterráneas sólo interviene, en la regulación de las poblaciones de colémbolos, el contenido en agua, teniendo la temperatura un valor secundario (Poinsot, 1976, 1984). La influencia de estos dos factores origina el desarrollo de un conjunto de estrategias variables según las especies (Greenslade, 1981). Así han sido ampliamente estudiados los fenómenos de ecomorfosis y ciclomorfosis como adaptaciones, sobre todo morfológicas, a condiciones extremas de temperatura y humedad, o debidas a variaciones estacionales (Cassagnau, 1986 a y b). Otras especies adoptan mecanismos de supervivencia diferentes, retirándose a microcavidades que obturan construyéndose un refugio en el que pasan la etapa más seca del medio en que viven. Asociado a este comportamiento constructor entran en un estado de vida latente llamado anhidrobiosis, durante el cual los animales inactivos permanecen "desecados", minimizando así el consumo de agua (Poinsot, 1966 a y b; 1968; Poinsot y Barra, 1978, 1991; Barra y Poinsot, 1977).
La función de los colémbolos en el suelo
Los animales del suelo son reguladores de los procesos de degradación de la materia orgánica, estableciéndose unas relaciones complejas entre los microartrópodos y la microflora. Esta simbiosis microfauna-microflora tiene como resultado una más eficaz degradación total de la materia orgánica (Butcher et al., 1971; Vannier, 1980; Petersen y Luxton, 1982; Cancela Da Fonseca y Poinsot, 1983). Los colémbolos participan en la actividad microbiana de los suelos de varios modos:
1. Fraccionan y trituran los restos vegetales. Esta acción mecánica es primordial para aumentar la superficie de implantación de la microflora.
2. Teniendo en cuenta el principio de la exclusión competitiva, los elementos ingeridos son degradados selectivamente por las especies gracias a su equipamiento encimático específico. De esta forma, pueden participar directamente en la formación de sustancias húmicas (humus coprógeno) que forman agregados complejos en los que se encuentran íntimamente mezcladas la materia orgánica y la fracción arcillosa del suelo. Además, las heces estimulan el crecimiento de gérmenes microbianos.
3. Participan en el control y dispersión de los microorganismos, ya que los materiales que ingieren son imperfectamente digeridos, y una parte importante es expulsada en forma de microorganismos aún viables. Así, participan en la renovación de especies microbianas, inoculándolas en sustratos que no están aún colonizados. Esta diseminación selectiva es más eficaz que el transporte accidental de gérmenes en la superficie del cuerpo de los animales.
Al estudiar el contenido del tubo digestivo de los colémbolos se ve que predominan los elementos fúngicos, en mayor o menor grado de lisis, íntimamente mezclados con bacterias que forman parte del bolo alimentario y que muy probablemente han sido ingeridas a la vez que la materia fúngica. Se puede concluir que una gran parte de los colémbolos edáficos son coprófagos, alimentándose de deyecciones de otros animales del suelo, fundamentalmente ácaros oribátidos y enquitreidos (Ponge, 1985, 1988).
Los colémbolos como indicadores de las características del suelo
La capacidad de adaptación de los colémbolos a distintos ambientes está relacionada con su carácter indicador de distintos parámetros edáficos. Varios autores han puesto de manifiesto las relaciones existentes entre las poblaciones de colémbolos y los distintos niveles de desarrollo del ecosistema edáfico, constituyendo los colémbolos unos buenos indicadores de la naturaleza, del nivel de actividad o de las modificaciones eventuales de un suelo. Ya Gisin (1943) indicó que diferentes especies se hallan restringidas a suelos ácidos o básicos, constituyéndose en indicadoras del pH del medio. Más tarde Ponge (1980, 1983) pone en evidencia este hecho observando cómo el tipo de suelo aparece como uno de los principales factores de variación específica. Son ya abundantes las citas de autores que inciden en cómo los cambios en la estructura y funcionamiento de varios hábitats en diferentes ecosistemas repercuten en la estructura de las poblaciones colembológicas (Czarnecki, 1983). Todos los autores que han estudiado el efecto de las prácticas silvícolas sobre los microartrópodos edáficos, coinciden en que la deforestación y la repoblación implican una neta ruptura de los equilibrios biocenóticos a nivel de la fauna de colémbolos (Bonnet, Cassagnau y Deharven, 1976, 1977, 1979; Arbea y Jordana, 1985, 1990)
Conocimiento de los colémbolos en Zaragoza
Los primeros colémbolos conocidos de la provincia de Zaragoza se recogen en los trabajos de Navas (1906) y Pitarque (1906), pioneros en el conocimiento de la fauna de colémbolos de la península Ibérica. Con posterioridad a estos trabajos, en los que se recogen 14 especies, son pocas y aisladas las contribuciones al conocimiento de la fauna colembológica de esta provincia hasta que Arbea y Jordana (1989), estudiando la fauna edáfica del Macizo del Moncayo, hacen que la lista de colémbolos de Zaragoza ascienda a 70 especies. Desde entonces, solamente hay que añadir cinco especies nuevas: Xenyllogastrura steineri Jordana y Arbea (Jordana y Arbea, 1992), Spatulosminthurus betschi Nayrolles (Nayrolles, 1990), Cassagnaudiella pruinosa (Tullberg, 1871) y C. trichroma Nayrolles (Nayrolles, 1995a), y Sminthurus hispanicus Nayrolles (Nayrolles, 1995b). En los últimos años, gracias al ingente trabajo de muestreo realizado por uno de los autores (J.B.Z.) en La Retuerta de Pina, entre los años 1990 y 1995, nuestro conocimiento de la fauna de colémbolos de Zaragoza se ha visto incrementado considerablemente. En esta zona de los Monegros se ha encontrado un total de 68 especies de colémbolos pertenecientes a 37 géneros (Arbea, 1999), con lo que el catálogo de colémbolos de la provincia de Zaragoza alcanza las 120 especies.
II. Métodos de estudio de los colémbolos en Los Monegros
Área de estudio
La Comarca de Los Monegros se enclava en el centro de la Depresión del Ebro, extendiéndose por las provincias de Huesca y Zaragoza. El clima puede considerarse como continental árido (Ochoa, 1982) caracterizándose por temperaturas anuales extremas (de -10ºC a más de 40ºC), pluviometría media anual escasa (200-400 mm) con déficit hídrico superior a los 300 mm y vientos dominantes (del NO y SE principalmente) de gran capacidad desecadora. Estas condiciones climáticas determinan la existencia de una vegetación clímax representada en las alturas inferiores a 400 m.s.n.m. por sabinares de Juniperus thurifera L. característicos de la asociación Juniperetum phoeniceo-thuriferae (Br.-Bl. & O. Bolòs) Rivas-Martínez (Rivas-Martínez, 1987), si bien, y por influencia antrópica, esta comunidad ha desaparecido prácticamente de la región estando su mejor exponente relegado a unas 2.000 hectáreas en el paraje conocido como "Retuerta de Pina", término municipal de Pina de Ebro (Zaragoza), comprendido en la cuadrícula UTM 30TYL29. Es en este enclave donde se ha realizado el muestreo que ha dado origen al presente trabajo.
El sabinar de Retuerta de Pina se asienta en las laderas y cimas de una compleja red de barrancos de fondo plano, cuya facies litológica representativa es la "formación Retuerta" del Mioceno (Quirantes, 1978) esencialmente yesífera, a base de yesos masivos blancos o muy claros y limos yesíferos. La altura sobre el nivel del mar va desde los 300 a los 400 metros. Los usos actuales de la zona más relevantes son la agricultura y la ganadería. Se cultivan cereales de invierno (cebada y trigo, principalmente) en secano y con régimen de año y vez. La superficie ocupada por cultivos es muy importante y rompe la continuidad de la vegetación natural. El aprovechamiento ganadero se limita al ganado ovino en régimen extensivo, utilizando los recursos forrajeros de barbechos y rastrojos. El manejo del ganado favorece la diseminación por la zona de edificios, en uso o en ruina, que mantienen algunas especies de carácter antropófilo. Igualmente, la ausencia total de manantiales o corrientes de agua hace necesario, para abrevar el ganado, la construcción de aljibes (especie de albercas que recogen agua de lluvia por escorrentía), que son los únicos puntos de agua del área.
Biotopos estudiados
Con el fin de profundizar en la ecología de los microartrópodos en los Monegros se han estudiado las poblaciones de colémbolos en varios biotopos, tanto edáficos como epígeos, representativos de los diferentes tipos de comunidades vegetales presentes en el paraje de "Retuerta de Pina", en el municipio de Pina de Ebro (Zaragoza). La vegetación típica es el sabinar característico de la asociación Juniperetum phoenicio-thuriferae (Br.-Bl. & O. Bolòs) Rivas Martínez. El carácter aclarado inherente a la estructura de este tipo de formaciones boscosas (Álvarez, 1992), permite la presencia como sotobosque de diversas comunidades vegetales que variarán en función de factores edáficos y de orientación, apareciendo en las zonas aclaradas cuatro tipos de comunidades: matorrales más o menos densos, gramíneas estépicas, comunidades nitrófilas y comunidades halófilas.
Se han analizado las poblaciones de colémbolos edáficos bajo 22 especies vegetales representativas de los diferentes tipos de comunidades vegetales presentes en este sabinar y que se pueden agrupar en cuatro clases fitosociológicas (Braun-Blanquet y Bolòs, 1957; Ochoa, 1982):
I. Lygeo-Stipetea Rivas Martínez, 1977. Incluye:
Gramíneas Estépicas de la alianza Agropyro Lygeion, que suelen ocupar fondos de valle o base de laderas orientadas al norte, siempre que exista un sustrato de suelo profundo; con: 1A. Salvia lavandulifolia, 1B. Agropyrum spp., Lygeum spartum.
Comunidades Nitrófilas de la alianza Salsolo peganion, que ocupan antiguos campos abandonados y lugares donde se acumula materia orgánica, principalmente originada por ganado ovino y conejo, Oryctolagus cuniculus (L.); con: 2A. Artemisia herba-alba, 2B. Salsola vermiculata.
II. Arthrocnemetea Br.-Bl. & R.Tx., 1943.
Comunidades Halófilas de la alianza Suaedion verae, que coloniza en la zona antiguos campos de cultivo salinizados; con: 3A. Suaeda vera, 3B. Atriplex halimus, 3C. Frankenia thymifolia.
III. Ononido-Rosmarinetea Br.-Bl., 1947.
Son Matorrales más o menos densos de la alianza Gypsophilion hispanicae (Br.-Bl.) Br.-Bl. & O. Bolòs. Se han estudiado:
4A. Gypsophila struthium.
Asociación Helianthemetum squamati, matorral aclarado y ralo sobre suelos yesosos esqueléticos que ocupa vertientes y cimas soleadas y secas en los cerros erosionados; con: 5A. Helianthemum squamatum
Asociación Lepidietum subulati, asociación muy pobre en especies que coloniza las pendientes de enclaves excepcionalmente áridos, sobre polvo de yeso estabilizado por una costra liquénica; con: 6A. Lepidium subulatum.
Asociación Ononidetum tridentatae, matorral denso y vigoroso sobre suelos yesosos profundos; con: 7A. Ononis tridentata, 7B. Rosmarinus officinalis, 7C. Thymus vulgaris, 7D. Lithodora fruticosa, 7E. Santolina chamaecyparissus, 7F. Krasceninnikovia ceratoides.
Asociación Ononidetum tridentatae, subasociación Pinetosum halepensis, muestra un matorral más denso donde los árboles no han desaparecido, tiene un carácter más montano ocupando por tanto las zonas más elevadas del área; con: 8A. Pinus halepensis, 8B. Juniperus phoenicea.
IV. Quercetea ilicis Br.-Bl., 1947.
Sabinar: es la vegetación típica de la región y pertenece a la asociación Juniperetum phoenicio-thuriferae (Br.-Bl. & O. Bolòs) Rivas Martínez. Se han estudiado: 9A. Ephedra nebrodensis, 9B. Quercus coccifera, 9C. Rhamnus lycioides, 9D. Juniperus thurifera
Métodos de muestreo
Se han utilizado diferentes métodos de manera simultánea, para muestrear las poblaciones de colémbolos, lo cual hace posible obtener una imagen más completa de la biodiversidad tanto en el suelo como en superficie (Chagnon et al., 2000):
Trampa Moericke. Se trata de un recipiente metálico, amarillo por dentro y verde por fuera, de 60x60x10 cm colocado sobre un soporte a una altura de 70 cm y rellenado con agua jabonosa. El período de funcionamiento fue de mayo de 1990 a diciembre de 1991, con dos períodos, agosto-septiembre de 1990 y julio-septiembre de 1991, en que fue retirada. La trampa fue colocada en el típico Ononidetum tridentatae.
Platos de colores. Se utilizaron 25 recipientes de plástico coloreado (9 amarillos, 8 azules y 8 blancos) de 26x16x4 cm rellenados con agua jabonosa. Fueron usados desde febrero de 1990 hasta diciembre de 1991, si bien sólo en este último año con regularidad una vez por quincena y durante 24 horas. Se distribuyeron indistintamente por el área de estudio muestreando todas las comunidades vegetales.
Trampa Malaise. Fueron usadas dos trampas Malaise de 189 cm de largo, 121 cm de ancho y una altura de 206 a 183 cm. El líquido colector fue alcohol al 70%. Estuvieron en funcionamiento desde septiembre de 1990 hasta diciembre de 1991, siendo ubicadas a una distancia de 23 metros en el Ononidetum tridentatae.
Trampa de luz. Consiste en dos lámparas de 20W/10S (de luz blanca y negra, respectivamente) alimentadas con una batería de 12V. Los especímenes eran retirados directamente con un aspirador. Fue utilizada regularmente desde primeros de enero hasta finales de diciembre de 1993, agrupándose las capturas por quincenas. La exposición de la trampa por quincena varió desde un mínimo de 6 horas hasta un máximo de 12, en función de la luminosidad lunar o condicionamientos atmosféricos. Fue ubicada indistintamente por toda la zona. Otros muestreos con trampa de luz fueron realizados de forma puntual y no sistemática en fechas anteriores a la expuesta. Se incluyen también en este apartado los ejemplares atraídos por las luces del Hotel y/o Gasolinera del Ciervo, situados en el km 381 de la N-II Madrid-Barcelona.
Trampas de caída. Se usaron 12 botellines de plástico de 14 cm de alto por 8 cm de ancho, con una abertura de 5 cm. Eran enterrados a ras de superficie sin tapar la boca de entrada y cebados con cerveza (año 1991, en el Ononidetum tridentatae) y vinagre (año 1992, en el Agropyro-Lygeion). Fueron colocados en fila a una distancia de 10 m uno de otro.
Barrido sobre plantas. Durante 1992, se manguearon una vez por quincena, y desde enero hasta diciembre, un total de 21 especies vegetales: el Agropyro-Lygeion, Artemisia herba-alba Asso, Atriplex halimus L., Ephedra nebrodensis Tineo ex Guss., Genista scorpius (L.)DC., Gypsophila struthium L. ssp. hispanica (Willk.) G. López, Helianthemum squamatum (L.) Pers., Juniperus phoenicea L., Juniperus thurifera L., Lithodora fruticosa (L.) Griseb (sólo de abril a septiembre), Ononis tridentata L., Osyris alba L., Pinus halepensis Miller, Quercus coccifera L., Retama sphaerocarpa (L.) Boiss, Rhamnus lycioides L., Rosmarinus officinalis L., Salsola vermiculata L., Santolina chamaecyparissus L., Suaeda vera J.F. Gmelin y Tamarix canariensis Willd. Con la misma frecuencia se han muestreado durante 1994, Asparagus acutifolius L., Frankenia thymifolia Desf., Lepidium subulatum L., Peganum harmala L. (de marzo a julio), Salvia lavandulifolia Vahl. y Thymus vulgaris L.. Otras recolecciones tuvieron lugar con anterioridad y posterioridad a la fecha expuesta sobre estas especies, así como en otras plantas.
Trampa Wilkening. Se utilizaron 4 trampas construidas según el modelo diseñado por Wilkening et al. (1981) y con unas dimensiones de 34 cm de alto por 11 cm de ancho. Se colocaron en el interior de las ramas de Juniperus phoenicea, Juniperus thurifera y Pinus halepensis y entre matas de Rosmarinus officinalis, respectivamente, durante enero a diciembre de 1992. En abril y mayo de 1994 se volvió a utilizar esta técnica únicamente para muestrear Juniperus thurifera.
Embudo Berlese. Se muestreó, una vez por estación (invierno, verano y otoño en 1994, primavera en 1995), el suelo bajo 20 especies vegetales: el Agropyro-Lygeion, Artemisia herba-alba, Atriplex halimus, Ephedra nebrodensis, Gypsophila struthium ssp. hispanica, Helianthemum squamatum, Juniperus phoenicea, Juniperus thurifera, Lithodora fruticosa, Ononis tridentata, Pinus halepensis, Quercus coccifera, Rosmarinus officinalis, Salsola vermiculata, Santolina chamaecyparissus, Suaeda vera, Frankenia thymifolia, Salvia lavandulifolia y Thymus vulgaris. Se tomaba una muestra superficial de suelo de un kilo de peso que se mantenía en el embudo, sin luz, durante quince días.
Paralelamente se tomaba otra muestra de 4 kilos de peso que se examinaba de "visu". Se utilizó el embudo Berlese, tanto con muestras de suelo como con madera muerta y restos de varias especies vegetales (Onopordum nervosum Boiss. y Onopordum corymbosum Willk., principalmente) en algunas ocasiones, aunque sólo de forma esporádica y no sistemática.
Igualmente, han aportado datos otros sistemas de muestreo que o bien siendo sistemáticos no han resultado eficientes para este grupo, como trampas de emergencia de frutos (de Juniperus thurifera, Juniperus phoenicea y Retama sphaerocarpa), trampas de cebo con carroña o trampas de intercepción de artrópodos en madrigueras de conejo (Oryctolagus cuniculus), o no se han utilizado regularmente como es el caso de la visita a edificios o aljibes y la prospección de piedras o cortezas de Juniperus thurifera. Se incluirían igualmente aquí los ejemplares localizados de "visu".
III. Las poblaciones de colémbolos en Los Monegros
Modos de vida de los colémbolos en Los Monegros
En los Monegros, como en todas las regiones mediterráneas, la sequedad estival es la principal fuerza selectiva que actúa sobre los animales del suelo. Para paliar esta falta de humedad los colémbolos siguen varias estrategias, que pueden observarse en las especies que viven en Los Monegros:
1. Unas especies son capaces de sobrevivir durante períodos más o menos largos de tiempo en estado de anhidrobiosis (representantes de los géneros Pseudachorutes, Brachystomella y Folsomides). Estos estados de anhidrobiosis se acompañan de modificaciones morfológicas, así Brachystomella parvula (Fig. 1) y Pseudachorutes parvulus (Fig. 2) muestran una coloración rojiza; las antenas se acortan y quedan replegadas hacia cada lado de la cabeza; hay una compresión longitudinal de los primeros segmentos del cuerpo, quedando el primer terguito torácico oculto; la furca queda replegada hacia la cara ventral del abdomen y las patas se recurvan hacia la línea media.
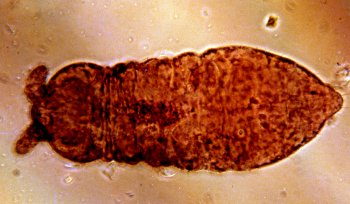
Figura 1. Aspecto de Brachystomella parvula en anhidrobiosis.
Brachystomella parvula, habitus of a specimen in anhydrobiosis.

Figura 2. Aspecto de Pseudachorutes parvulus en anhidrobiosis.
Pseudachorutes parvulus, habitus of a specimen in anhydrobiosis.2. Otras especies presentan adaptaciones morfológicas para reducir la transpiración de la superficie del cuerpo, como son la presencia de escamas o una cubierta densa de pelos, unido a una intensa pigmentación. Esto es típico de los Entomobriomorfos, como en los géneros Entomobrya, Heteromurus, Lepido-cyrtus (Fig. 3) y Seira (Fig. 4), que son especies epígeas características de los biotopos de Monegros.
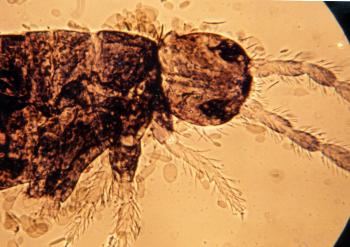
Figura 3. Aspecto de Lepidocyrtus sp. Región anterior. |

Figura 4. Aspecto de Seira sp. Región
anterior. |
3. En otras especies se han desarrollado estructuras cuticulares engrosadas en el sexto terguito abdominal, que han quedado fijadas de tal modo que son características y definitorias de una especie o incluso un género. Estas estructuras, que suponen una adaptación a los medios con altas temperaturas y déficit hídrico, y que seguramente están relacionadas con los fenómenos de ecomorfosis que muestran algunas especies de colémbolos en climas templado-húmedos, las encontramos en las especies Anurophorus racovitzai (Fig. 5) y Proctostephanus n. sp. (Fig. 6), ambas típicas de regiones mediterráneas.

Figura 5. Anurophorus racovitzai.
Engrosamiento cuticular del sexto terguito abdominal. |

Figura 6. Proctostephanus n. sp. Corona
quitinosa característica del sexto terguito abdominal. |
Los colémbolos se pueden clasificar en varias categorías morfoecológicas, teniendo en cuanta a la vez su fisionomía y su asociación a diferentes medios: los atmobios, típicos de la superficie del suelo o de las plantas, tienen las antenas y la furca largas, pigmentación desarrollada y ocho ojos a cada lado de la cabeza; los hemiedáficos presentan antenas moderadamente largas y pigmento bien desarrollado; los euedáficos, característicos de las capas profundas del suelo, tienen antenas cortas, furca y ojos reducidos o ausentes, y carecen de pigmento o está reducido éste a los ojos. Los hemiedáficos se subdividen en higrófilos, con el mucrón desarrollado y viviendo en la superficie del agua o estrechamente ligados a ella, mesófilos, con mucrón normal, pocas sedas con el ápice engrosado en los tibiotarsos y habitando la parte superficial del suelo y el mantillo, y los xerófilos, que poseen mucrón normal, numerosas sedas tibiotarsales con el ápice engrosado, pigmentación muy densa y viven en musgos, líquenes y cortezas.
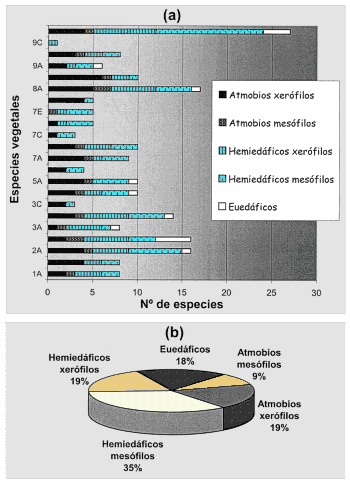
Figura 7. Distribución de las especies de
colémbolos por categorías morfoecológicas. a) Porcentajes en los
diferentes biotopos de la región de Monegros estudiada. b) Porcentajes en
el total de la región estudiada. |
La fauna de colémbolos de los Monegros está dominada por los elementos hemiédaficos (54% de las especies), tanto mesófilos como xerófilos. Destaca el bajo porcentaje de especies euedáficas (18%) y la mayor proporción de atmobios (28%), mayoritariamente xerófilos (Fig. 7). Este gran predominio y variedad de las especies con un modo de vida epigeo, sin duda está relacionado con la gran biodiversidad que se encuentra en los estratos herbáceo, muscinal y liquénico en estas zonas en las que predomina el carácter abierto de la vegetación.
En los colémbolos que viven en Monegros la alimentación coprófaga es la más frecuente, encontrándose en el tubo digestivo un bolo alimentario compuesto por material fúngico -hifas y esporas más o menos melanizadas y trituradas- íntimamente mezcladas con bacterias (Fig. 8 a). Algunas especies, como Brachystomella parvula, parecen tener un régimen alimentario micófago, encontrándose en su tubo digestivo material fúngico sin bacterias (Fig. 8 b). Las especies epigeas de mayor tamaño, como Seira y Entomobrya muestran comportamientos alimentarios coprófagos, con una mayor frecuencia de esporas fúngicas en sus bolos alimentarios (Fig. 8 c) y siendo frecuente la presencia de mudas propias o de otros microartrópodos (Fig. 8 d).
Composición faunística
En esta zona de los Monegros se han encontrado un total de 68 especies de colémbolos pertenecientes a 37 géneros (Arbea, 1999), lo cual representa una biodiversidad elevada teniendo en cuenta que las condiciones extremas de este ambiente, especialmente el estrés hídrico, no son a priori favorables para la vida de los colémbolos. En los biotopos que nos interesan en este trabajo, se han encontrado 57 especies de colémbolos, de las que diez especies pueden considerarse representativas de la región, al estar presentes en todas las clases fitosociológicas estudiadas (Tabla I). Estas diez especies tienen un comportamiento marcadamente xerófilo o son capaces de resistir períodos de altas temperaturas y baja humedad: tres especies son atmobias xerófilas, Entomobrya sp., Sminthurus hispanicus y Spatulosminthurus betschi; cuatro son hemiedáficas xerófilas, Xenylla brevisimilis mediterranea, Xenylla maritima, Cryptopygus thermophilus y Lepidocyrtus sp.; y tres son hemiedáficas mesófilas, Sphaeridia pumilis, que sobrevive los períodos de sequía en estado de huevo, Brachystomella parvula y Folsomides portucalensis, que son capaces de resistir períodos de sequía entrando en anhidrobiosis.
De todos los biotopos estudiados es el Matorral el más diversificado, con 10 especies exclusivas (Onychiurus sp. grupo minutus, Folsomides n.sp., Isotomurus sp. grupo palustris, Pseudosinella sp., Seira domestica, Seira cf. saxatilis, Boernerides hystrix, Deuterosminthurus pallipes f. fenyesi, Fasciosminthurus saportae y Sminthurinus aureus var. ochropus), seguido por el Sabinar, con 6 (Xenylla franzi, Folsomia sp., Isotoma (Parisotoma) notabilis, Isotomodes trisetosus, Proisotoma juaniae y Proctostephanus n. sp.), las Comunidades Nitrófilas, con 5 (Xenyllogastrura steineri, Metaphorura affinis, Protaphorura quercetana, Isotomodes subarmatus y Sminthurinus cf. elegans) y las Comunidades Halófilas, con 3 (Ceratophysella succinea, Protaphorura fimata y Friesea oligorhopala).
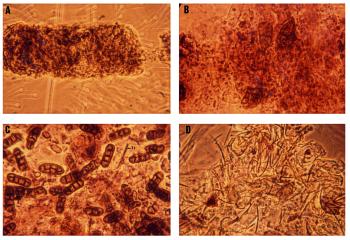
Figura 8. Alimentación de los colémbolos en los
Monegros. a) Cryptopygus thermophilus, hifas melanizadas muy
trituradas y bacterias. b) Brachystomella parvula, esporas
septadas muy digeridas. c) Entomobrya sp., esporas tabicadas y
bacterias; tricobotrio (tr). d) Entomobrya sp., muda de
artrópodo y bacterias. |
Tabla I
Lista de especies y número total de individuos encontrados en los biotopos de la región de Monegros estudiada. Para cada especie se indica el tipo de distribución geográfica (DG), su clasificación morfoecológica (MC) y la abreviatura utilizada en los análisis de correspondencias (ABR.). "+" = especie encontrada en muestras diferentes a las analizadas.
List of Collembola from the Monegros Region. The biogeographical type (DG), the life form (MC) and the abbreviation used in the correspondence analysis (ABR.) for each species is indicated. "+" = species found in different samples from the analyzed.
|
Gramíneas |
Nitrófilas |
Halófilas |
Matorral |
Sabinar |
|||||||||||||||||||||
|
ABR. |
DG |
CM |
1A |
1B |
2A |
2B |
3A |
3B |
3C |
4A |
5A |
6A |
7A |
7B |
7C |
7D |
7E |
7F |
8A |
8B |
9A |
9B |
9C |
9D |
|
|
HYPOGASTRURIDAE |
|||||||||||||||||||||||||
|
csu |
Ceratophysella succinea |
Ec |
Hm |
- |
- |
- |
- |
- |
15 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
cin |
Choreutinula inermis |
P |
Hm |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
20 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
|
hve |
Hypogastrura vernalis |
P |
Hm |
- |
- |
1 |
16 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4 |
- |
- |
12 |
|
sun |
Schoettella ununguiculata |
H |
Hm |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
22 |
|
xbm |
Xenylla brevisimilis mediterranea |
MA |
Hx |
- |
- |
6 |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
23 |
- |
- |
- |
4 |
19 |
|
xfr |
Xenylla franzi |
Ib |
Hx |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
19 |
|
xma |
Xenylla maritima |
C |
Hx |
5 |
7 |
3 |
26 |
26 |
2 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4 |
- |
- |
- |
- |
10 |
|
xoc |
Xenyllogastrura octoculata |
Ib |
Hm |
- |
- |
2 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4 |
|
xst |
Xenyllogastrura steineri |
Ib |
E |
- |
- |
2 |
4 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
ONYCHIURIDAE |
|||||||||||||||||||||||||
|
mit |
Mesaphorura italica |
E |
E |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4 |
- |
- |
- |
- |
2 |
|
mma |
Mesaphorura macrochaeta |
C |
E |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
5 |
|
maf |
Metaphorura affinis |
P |
E |
- |
- |
- |
10 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
omi |
Onychiurus sp. grupo minutus |
En |
E |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
pfi |
Protaphorura fimata |
E |
E |
- |
- |
- |
- |
- |
8 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
pne |
Protaphorura nemorata |
E |
E |
- |
- |
- |
- |
- |
- |
- |
- |
3 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
2 |
|
pqu |
Protaphorura quercetana |
Ib |
E |
- |
- |
- |
24 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
NEANURIDAE |
|||||||||||||||||||||||||
|
bpa |
Brachystomella parvula |
C |
Hm |
5 |
1 |
2 |
- |
1 |
- |
- |
4 |
26 |
12 |
54 |
12 |
2 |
30 |
2 |
18 |
- |
- |
- |
23 |
- |
70 |
|
fol |
Friesea oligorhopala |
H |
Hm |
- |
- |
- |
- |
- |
10 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
pco |
Pseudachorutes corticicolus |
H |
Hm |
- |
- |
- |
- |
- |
- |
- |
3 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
3 |
|
ppa |
Pseudachorutes parvulus |
H |
Hm |
- |
- |
1 |
14 |
- |
- |
- |
- |
- |
- |
- |
6 |
- |
- |
1 |
- |
1 |
- |
- |
- |
- |
8 |
|
ppl |
Pseudachorutes plurichaetosus |
Ib |
Hx |
- |
- |
- |
10 |
- |
6 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
ISOTOMIDAE |
|||||||||||||||||||||||||
|
ara |
Anurophorus racovitzai |
Ec |
Hx |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
2 |
|
cth |
Cryptopygus thermophilus |
C |
Hx |
29 |
- |
7 |
5 |
4 |
25 |
- |
10 |
- |
- |
- |
28 |
- |
- |
- |
- |
2 |
13 |
7 |
2 |
- |
51 |
|
fos |
Folsomia sp. |
En |
Hm |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
|
fpo |
Folsomides portucalensis |
Ib |
Hm |
14 |
1 |
11 |
- |
- |
- |
27 |
- |
- |
2 |
- |
- |
- |
4 |
- |
- |
- |
- |
- |
5 |
- |
12 |
|
fsp |
Folsomides n.sp. |
En |
Hm |
- |
- |
- |
- |
- |
- |
- |
- |
104 |
- |
- |
- |
- |
- |
2 |
- |
1 |
1 |
- |
- |
- |
- |
|
ids |
Isotoma (Desoria) sp. |
En |
Hm |
- |
- |
1 |
- |
- |
14 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
ino |
Isotoma (Parisotoma) notabilis |
C |
Hm |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
7 |
|
isu |
Isotomodes subarmatus |
Ib |
E |
- |
- |
- |
2 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
itr |
Isotomodes trisetosus |
C |
E |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4 |
- |
- |
- |
|
isp |
Isotomurus sp. grupo palustris |
En |
Am |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
pju |
Proisotoma juaniae |
Ib |
Hm |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
5 |
- |
- |
12 |
|
prs |
Proctostephanus n.sp. |
En |
Hx |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
23 |
|
ENTOMOBRYIDAE |
|||||||||||||||||||||||||
|
eat |
Entomobrya atrocincta |
C |
Ax |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
|
emu |
Entomobrya multifasciata |
H |
Am |
1 |
- |
- |
8 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
2 |
- |
- |
1 |
- |
4 |
|
esp |
Entomobrya sp. |
En |
Ax |
1 |
2 |
2 |
- |
1 |
4 |
1 |
2 |
1 |
1 |
1 |
- |
1 |
1 |
- |
- |
- |
2 |
- |
- |
- |
- |
|
hma |
Heteromurus major |
C |
Am |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
217 |
|
hsp |
Heteromurus sp. |
En |
Ax |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4 |
- |
5 |
- |
- |
|
lsp |
Lepidocyrtus sp. |
En |
Hx |
4 |
1 |
8 |
10 |
2 |
1 |
- |
2 |
- |
- |
- |
10 |
- |
- |
- |
- |
20 |
- |
- |
4 |
- |
8 |
|
phe |
Pseudosinella helenae |
Ib |
Hm |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
psp |
Pseudosinella sp. |
En |
Hm |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
2 |
- |
- |
- |
- |
- |
- |
- |
- |
|
sdo |
Seira domestica |
C |
Am |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
+ |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
ssa |
Seira cf. saxatilis |
Ec |
Ax |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
|
ssp |
Seira sp. |
En |
Ax |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
1 |
|
|
SYMPHYPLEONA |
|||||||||||||||||||||||||
|
bhy |
Boernerides hystrix |
MA |
Hm |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
bpr |
Bourletiella (C.) pruinosa |
MA |
Ax |
- |
4 |
3 |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
1 |
1 |
1 |
- |
- |
- |
- |
|
bcr |
Bourletiella (C.) cruciata |
Ec |
Ax |
- |
- |
- |
- |
- |
3 |
2 |
- |
- |
- |
- |
- |
- |
- |
- |
2 |
1 |
- |
- |
- |
- |
- |
|
dpf |
Deuterosminthurus pallipes f. fenyesi |
Ec |
Ax |
- |
- |
- |
- |
- |
- |
- |
1 |
1 |
- |
1 |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
|
fsa |
Fasciosminthurus saportae |
Ib |
Ax |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
1 |
1 |
- |
- |
- |
- |
- |
|
sal |
Sminthurinus alpinus |
Ec |
Hx |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
1 |
|
sau |
Sminthurinus aureus var. ochropus |
P |
Hx |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
4 |
2 |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
|
sel |
Sminthurinus cf. elegans |
H |
Hx |
- |
- |
- |
10 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
- |
- |
- |
- |
|
shi |
Sminthurus hispanicus |
Ib |
Ax |
1 |
1 |
1 |
1 |
- |
- |
- |
1 |
1 |
1 |
1 |
1 |
- |
- |
- |
3 |
1 |
- |
1 |
1 |
- |
1 |
|
svi |
Sminthurus viridis |
C |
Am |
- |
- |
1 |
1 |
1 |
1 |
- |
1 |
1 |
- |
1 |
- |
- |
- |
1 |
- |
1 |
1 |
- |
- |
- |
- |
|
sbe |
Spatulosminthurus betschi |
Ib |
Ax |
- |
1 |
1 |
- |
- |
1 |
- |
- |
- |
- |
1 |
1 |
- |
- |
- |
- |
- |
1 |
1 |
1 |
- |
1 |
|
spu |
Sphaeridia pumilis |
H |
Hm |
- |
- |
- |
4 |
- |
- |
- |
3 |
1 |
- |
3 |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
1 |
|
stv |
Stenacidia violacea |
H |
Hm |
- |
- |
- |
- |
- |
- |
- |
- |
3 |
- |
- |
- |
- |
- |
- |
- |
1 |
- |
- |
- |
- |
6 |
|
Nº EJEMPLARES |
60 |
18 |
52 |
146 |
37 |
92 |
30 |
28 |
142 |
16 |
67 |
85 |
4 |
38 |
7 |
25 |
66 |
26 |
22 |
42 |
4 |
268 |
|||
|
Nº ESPECIES |
8 |
8 |
16 |
16 |
8 |
14 |
3 |
10 |
10 |
4 |
9 |
10 |
3 |
5 |
5 |
5 |
17 |
10 |
6 |
8 |
1 |
27 |
|||
|
RIQUEZA |
1,7 |
2,4 |
3,8 |
3,0 |
1,9 |
2,9 |
0,6 |
2,7 |
1,8 |
1,1 |
1,9 |
2,0 |
1,4 |
1,1 |
2,1 |
1,2 |
3,8 |
2,8 |
1,6 |
1,9 |
0,0 |
4,7 |
|||
|
DIVERSIDAD |
1,5 |
1,8 |
2,4 |
2,4 |
1,1 |
2,1 |
0,4 |
2,0 |
0,9 |
0,8 |
0,9 |
1,8 |
1,0 |
0,8 |
1,6 |
1,0 |
2,0 |
1,7 |
1,6 |
1,5 |
0,0 |
2,5 |
|||
|
UNIFORMIDAD |
0,7 |
0,8 |
0,9 |
0,9 |
0,6 |
0,8 |
0,4 |
0,9 |
0,4 |
0,6 |
0,4 |
0,8 |
1,0 |
0,5 |
1,0 |
0,6 |
0,7 |
0,7 |
0,9 |
0,7 |
0,0 |
0,8 |
|||
|
DOMINANCIA |
0,3 |
0,2 |
0,1 |
0,1 |
0,5 |
0,2 |
0,8 |
0,2 |
0,6 |
0,6 |
0,7 |
0,2 |
0,4 |
0,6 |
0,2 |
0,5 |
0,2 |
0,3 |
0,2 |
0,3 |
1,0 |
0,1 |
|||
DG: C=cosmopolita; E=europea; Ec=circunmediterránea; En=endémica; H=holártica; Ib=ibérica; MA= mediterráneo-atlántica; P=paleártica.
CM: Am=atmobia mesófila; Ax=atmóbia xerófila; E=euedáfica; Hm=hemiedáfica mesófila; Hx=hemiedáfica xerófila.
Tanto el número de ejemplares como el número de especies presentan cambios notables a lo largo del año (Fig. 9). Las poblaciones son mucho mayores en Otoño e Invierno, mientras que durante el Verano, los colémbolos desaparecen prácticamente de casi todos los biotopos, o al menos no están en un estado fisiológico activo que permita su captura con los métodos de extracción y trampeo utilizados.
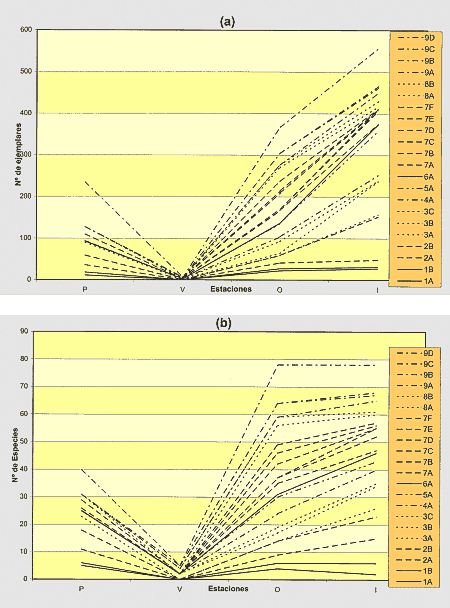
Figura 9. Variación estacional del número de
individuos (a) y del número de especies (b) en los diferentes biotopos
de la región de Monegros estudiada. P, primavera; V, verano; O, otoño;
I, invierno. |
Biodiversidad
Con el fin de comparar la estructura de las poblaciones de colémbolos en los distintos biotopos se ha calculado la diversidad según Shannon & Weaver, H' = – 3Pi ln Pi, y la Riqueza según Margalef, R = S–1/ln N; donde Pi es la abundancia de la especie i en el biotopo considerado, S es el número de especies, y N es el número de individuos.
Los valores de diversidad y riqueza de las poblaciones de colémbolos están muy relacionados con la cobertura vegetal de los biotopos en los que viven. Se pueden distinguir dos grandes grupos de biotopos según su diversidad específica (Fig 10):
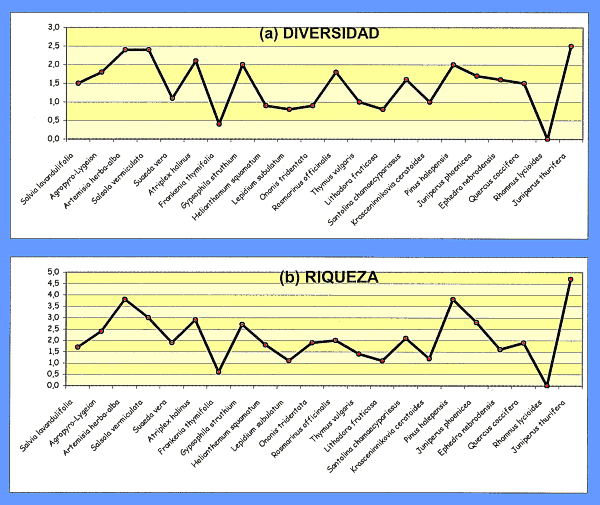
Figura 10. Valores de la diversidad específica
según Shannon & Weaver (a) y de la Riqueza específica según
Margalef (b) en los diferentes biotopos de la región de Monegros
estudiada. |
1. Biotopos con una escasa cobertura vegetal, desde herbáceas hasta matorrales enanos, con valores de H' comprendidos entre 0,0 y 1,0, y valores de R inferiores a 1,5. Se incluyen aquí Frankenia thymifolia dentro de las comunidades halófilas, los matorrales enanos de Lepidium subulatum, Thymus vulgaris, Lithodora fruticosa, Krasceninnikovia ceratoides dentro del matorral de Gypsophilion hispanicae, y Rhamnus lycioides dentro del sabinar.
2. Biotopos con una gran cobertura vegetal, desde submatorrales hasta árboles, con valores de H' comprendidos entre 1 y 2,5, y valores de R entre 1,5 y 5,0. Se incluyen aquí los restantes biotopos estudiados.
Relación entre los diferentes biotopos monegrinos en función de sus poblaciones de colémbolos
Para determinar los agrupamientos de los biotopos en función de sus perfiles faunísticos se realiza un análisis factorial de correspondencias que permite una representación objetiva del cuadro de contingencia (especies x biotopos). Las afinidades entre los biotopos y los agrupamientos que de ellas se derivan se han establecido comparando los biotopos dos a dos y calculando el coeficiente de similaridad de Jaccard: J = Nab/(Na+Nb-Nab), donde Nab es el número de especies comunes a los dos biotopos; Na y Nb son el número de especies de cada uno de los biotopos que se comparan. A partir de la matriz de similaridad entre los biotopos construimos la jerarquía correspondiente que se representa por un dendrograma. Para obtener la jerarquía hemos utilizado el método UPGMA.
En la figura 11 se representan los resultados del análisis factorial de correspondencias efectuado sobre las especies presentes en los biotopos estudiados (Tabla I). Los dos primeros ejes del análisis factorial de correspondencias explican el 32% del total de la varianza, y reflejan lo más importante de la estructura biocenótica de las poblaciones de colémbolos.
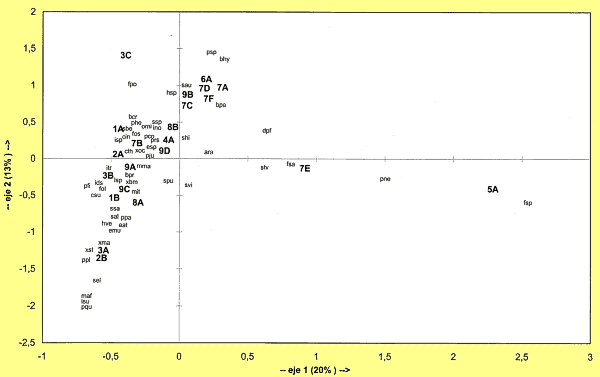
Figura 11. Análisis factorial de
correspondencias. Representación de los biotopos y las especies según
los dos primeros ejes. Datos según la Tabla I. |
El eje 1 (20% de la varianza) separa las comunidades más degradadas en los valores negativos: encontramos aquí los biotopos herbáceos o de submatorral correspondientes a las gramíneas estépicas (1A, 1B), las comunidades nitrófilas (2A, 2B) y las comunidades halófilas (3A, 3B, 3C), junto con las especies de colémbolos características de estos biotopos. En los valores más positivos del eje 1 aparecen los biotopos de matorral (4A - 8B) y de sabinar (9A, 9B, 9C).
En el dendrograma correspondiente a la clasificación jerárquica de los biotopos, construido en base al índice de similaridad de Jaccard, se observan tres grandes agrupamientos (Fig. 12):
1. Incluye la gramíneas estépicas, las comunidades nitrófilas, los dos biotopos halófilos más diversificados (Suaeda vera y Atriplex halinus), junto con algunos biotopos de Ononidetum (Rosmarinus officinalis y Pinus halepensis) y Quercus coccifera y Juniperus thurifera.
2. Incluye los matorrales de Ononidetum más diversificados (Gypsophila struthium, Ononis tridentata, Helianthemum squamatum y Juniperus phoenicea) junto con Ephedra nebrodensis.
3. Incluye los matorrales de Ononidetum más pobres en especies (Lepidium subulatum, Lithodora fruticosa, Thymus vulgaris, Krasceninnikovia ceratoides y Santolina chamaecyparissus) junto a otros biotopos, tambien muy pobres específicamente, de Frankenia thymifolia y Rhamnus lycioides.
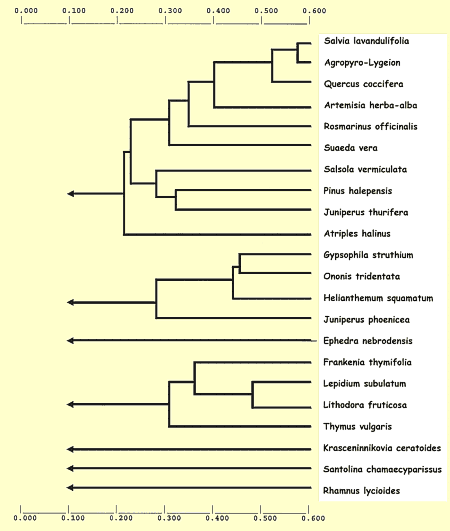
Figura 12. Dendrograma correspondiente a la
clasificación jerárquica de los biotopos según la similaridad de
Jaccard. Datos según la Tabla I. |
Estas relaciones entre las diferentes poblaciones colembológicas asociadas a cada comunidad vegetal se ven más claramente si agrupamos las especies que aparecen en cada una de las cinco comunidad fitosociológicas: sabinar, matorral, gramíneas estépicas, comunidades nitrófilas y comunidades halófilas. Al realizar un análisis factorial de correspondencias y una clasificación jerárquica de similaridad faunística según Jaccard a los datos reelaborados de esta forma se obtienen los resultados representados en las figuras 13 y 14. De estos resultados podemos concluir que, de acuerdo a sus poblaciones de colémbolos, se distinguen dos tipos de comunidades claramente diferenciadas faunísticamente y que se corresponden con una diferente cobertura vegetal y un distinto grado de degradación del medio natural. Por un lado están los biotopos con mayor cobertura vegetal del sabinar y el matorral, que presentan una similaridad faunística muy alta, y por otro lado las comunidades más degradadas, y con una cobertura vegetal menor, de gramíneas estépicas y biotopos nitrófilos y halófilos; estos tres tipos de medios son más diversos y presentan una menor similaridad faunística entre ellos, aunque faunísticamente se parecen más entre sí que a los dos primeros.
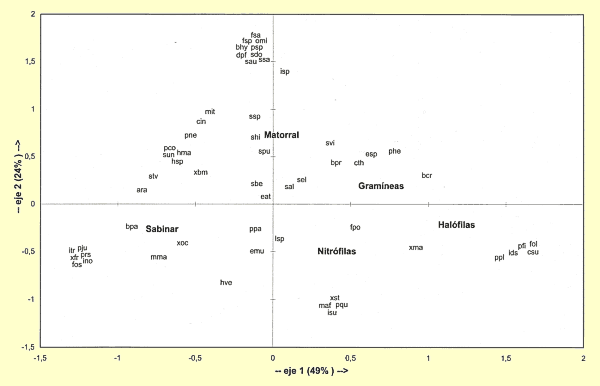
Figura 13. Análisis factorial de
correspondencias. Representación de las especies presentes en las cinco
comunidades fitosociológicas comprendidas en el área de estudio,
según los dos primeros ejes (explicación en el texto). |
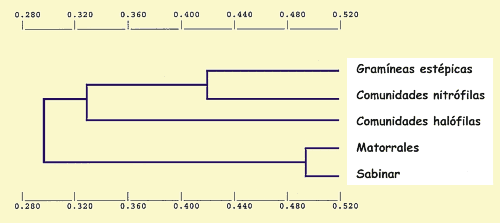
Figura 14. Dendrograma correspondiente a la
clasificación jerárquica de los biotopos según la similaridad
faunística de Jaccard. Datos según la Fig. 13. |
Esta separación observada entre los diferentes biotopos estudiados se evidencia tambien al analizar la similaridad entre las especies. La clasificación jerárquica de las 57 especies de colémbolos, con objeto de observar las afinidades entre las especies de colémbolos que viven en la región, ha proporcionado el dendrograma representado en la figura 15. Al nivel de similaridad de 0,50 aparecen formados 12 grupos de especies. Dos de ellos (grupos A y B) comprenden las 14 especies características de la región de Monegros estudiada. Otros dos (grupos D y E) incluyen las 10 especies exclusivas del matorral. Los grupos G, K y L corresponden a las especies exclusivas del sabinar, comunidades halófilas y comunidades nitrófilas, respectivamente. Las restantes especies de colémbolos, que se encuentran en varios biotopos, quedan distribuidas por los otros grupos del análisis (grupos C, F, H, I, J).
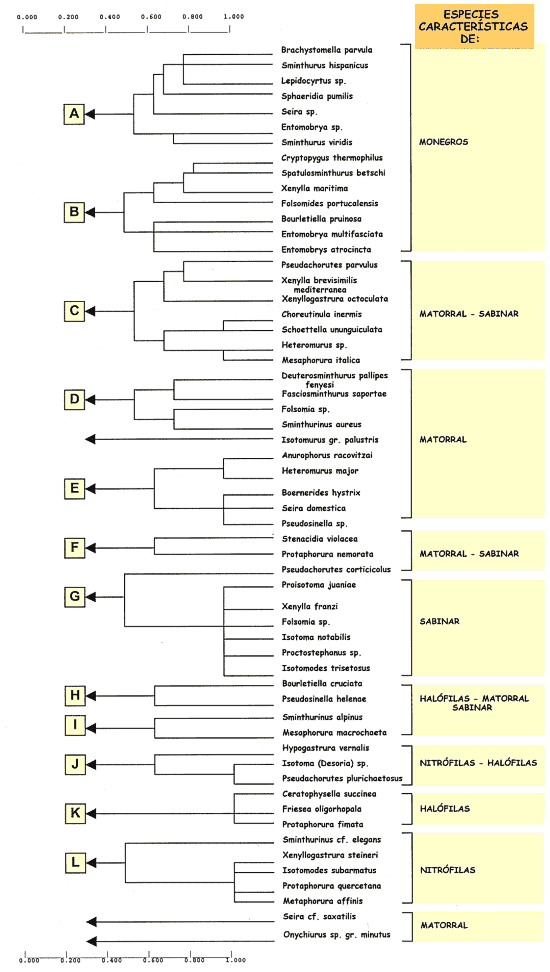
Figura 15. Dendrograma correspondiente a la
clasificación jerárquica de las especies según la similaridad
faunística de Jaccard. Se indican los grupos de especies
características de cada comunidad vegetal. |
Distribución biogeográfica
Al analizar la distribución biogeográfica de los colémbolos de La Retuerta de Pina destaca el elevado número de especies endémicas (Fig. 16). El 39 % de las especies son endémicas de la Península Ibérica o del Sur de Francia (distribución íberoprovenzal), constituyendo la mayor parte de ellas endemismos de la depresión del Ebro.
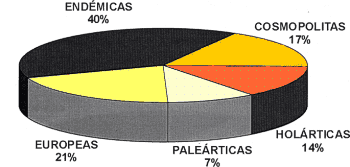
Figura 16. Espectro de repartición biogeográfica
de las especies de colémbolos de la región de Monegros estudiada. |
1. Amplia distribución (cosmopolita o subcosmopolita): 10 especies (17 %).
2. Holárticas: 8 especies (14 %). Es destacable la presencia de Xenylla humicola (Fabricius, 1780) y Schoettella ununguiculata (Tullberg, 1869) por ser especies raras en la península Ibérica.
3. Paleárticas: 4 especies (7 %). De ellas Choreutinula inermis (Tullberg, 1871) es rara en la Península.
4. Europeas: 12 especies (21 %) distribuidas preferentemente en las regiones meridionales. De ellas destacan seis especies por su rareza en la fauna ibérica: Seira cf. saxatilis (Carl, 1899), Bourletiella cruciata (Haybach, 1972), Sminthurinus alpinus Gisin, 1953 y Deuterosminthurus pallipes fenyesi (Stach, 1926) con una distribución circummediterránea (Europa y Norte de África, Boernerides hystrix (Börner, 1903) y Bourletiella pruinosa (Tullberg, 1871) que presenta una distribución Mediterráneo-Atlántico.
5. Endémicas: 23 especies (40 %) que se han encontrado sólo en la península Ibérica y, algunas de ellas, en el Sur de Francia. Estas especies las podemos agrupar en cinco categorías según su grado de endemismo:
a. Endémicas Peninsulares: 3 especies: Xenylla franzi Steiner, 1955, Xenyllogastrura octoculata (Steiner, 1955) y Proisotoma juaniae Luciañez y Simón, 1992.
b. Endémicas de la Depresión del Ebro (de Navarra a Barcelona): Sminthurus hispanicus Nayrolles, 1995.
c. Endémicas de la Depresión del Ebro (de Navarra a Zaragoza): seis especies: Xenyllogastrura steineri Jordana y Arbea, 1992, Pseudachorutes plurichaetosus Arbea y Jordana, 1991, Folsomides n. sp., Isotomodes subarmatus Jordana y Arbea, 1990, Pseudosinella helenae Arbea y Jordana, 1990 y Heteromurus n. sp.
d. Endémicas de la Depresión del Ebro (de Zaragoza a Barcelona): 4 especies: Protaphorura quercetana Mateos Frías y Arbea, 1986, Anurophorus racovitzai Denis, 1932, Fasciosminthurus cf. saportae Nayrolles, 1996 y Spatulosminthurus betschi Nayrolles, 1990.
e. Endémicas de La Retuerta de Pina: 8 especies: Onychiurus sp. grupo de O. minutus Denis, 1932, Proctostephanus n. sp., Seira n. sp., Cyphoda n. sp., Bourletiella sp. 1, Fasciosminthurus sp. A, F. sp. B, F. sp. C. Es de destacar la presencia de Cyphoda Delamare Deboutteville, 1948, género distribuido por África, Asia, Europa (Creta) y Australia, y que sólamente había sido citado hasta ahora en una ocasión para la Península Ibérica, en pinares de la Sierra de Gredos (Mateos y Selga, 1991).
Conclusiones
Podemos concluir que la fauna de colémbolos de los Monegros es fuertemente diversificada y singular, máxime cuando sólo se ha estudiado una pequeña fracción de la región, La Retuerta de Pina. Su singularidad viene avalada por el gran número de nuevas especies y de especies endémicas o raras. El porcentaje de endemismos es muy superior al de otras regiones de la Península. Así, estudiando la fauna de Colémbolos de áreas consideradas como fuertemente endémicas, Gama et al. (1997) encuentran un porcentaje del 11% de especies endémicas en el Sur de Portugal; estos porcentajes de endemismo son mayores en bosques de los Pirineos, oscilando entre el 21% y el 32% (Deharveng, 1996), mientras que, como ya hemos dicho, en La Retuerta de Pina el porcentaje de especies endémicas representa el 39%. Esta tasa de endemicidad es muy superior a la de otras regiones de clima mediterráneo, y es tan sólo comparable a la fauna de colémbolos insular y del mediterráneo oriental (Poinsot-Balaguer, 1984). Por lo tanto, podemos situar a Los Monegros entre las "zonas calientes" de la biodiversidad europea, con un elevado valor biológico debido al rico componente endémico de su biocenosis. Considerando que la fauna endémica representa uno de los elementos de mayor valor desde una perspectiva conservacionista, por ser el elemento más vulnerable, creemos que la región de Los Monegros merece una atención particular y debe ser considerada como prioritaria dentro de los planes de conservación de la naturaleza, con el fin de evitar la pérdida local de diversidad biológica.
Bibliografía
Álvarez, J. 1992. Los sabinares albares de la provincia de Guadalajara: estudio ecológico, florístico y fitosociológico y biología comparada de poblaciones de Juniperus thurifera L. Tesis Doctoral (inédita). Universidad de Alcalá de Henares, 446 pp.
Arbea, J. I. 1999. Collembola. En: Inventario de especies de Monegros. Blasco Zumeta, J. (coord.). Disponible desde Internet en: http://members.xoom.com/_XOOM/monegros/inventario/ collembolla.htm
Arbea, J. I. y Jordana, R. 1985. Efecto de una repoblación con coníferas en un robledal de Navarra sobre los colémbolos edáficos. Bolm. Soc. port. Ent., Supl. 1, Vol. 2: 277-286.
Arbea, J. I. y Jordana, R., 1990. Ecología de las poblaciones de colémbolos edáficos en un prado y un pinar de la región submediterránea de Navarra. Mediterránea Ser. Biol., 12: 139-148.
Arbea, J. I. y Jordana, R. 1989. Colémbolos del Moncayo (Zaragoza) (Insecta: Apterygota) I. Nota biogeográfica. Turiaso, 9: 571-583.
Barra, J. A. y Poinsot-Balaguer, N. 1977. Modifications ultrastructurales accompagnant l'anhydrobiose chez un collembole: Folsomides variabilis. Rev. Ecol. Biol. Sol, 14: 189-197.
Bonnet, L., Cassagnau, P. y Deharveng, L. 1976. Un exemple de rupture de l'equilibre biocénotique par dèboisement: les peuplements de collemboles èdaphiques du Piau d'Engaly (Hautes-Pyrénées). Rev. Ecol. Biol. Sol, 13: 337-351.
Bonnet, L., Cassagnau, P. y Deharveng, L. 1977. Influence du dèboisement et du reboisement sur les biocenoses de collemboles dans quelques sols pyrénéens. Bull. Ecol., 8: 321-333,
Bonnet, L., Cassagnau, P. y Deharveng, L. 1979. Recherche d'une méthodologie dans l'analyse de la rupture des équilibres biocénotiques: applications aux collemboles èdaphiques des Pyrénées. Rev. Ecol. Biol. Sol, 16: 373-401.
Braun-Blanquet, J. y Bolòs, O. 1957. Les groupements végétaux du bassin moyen de l'Ebre et leur dynamisme. An. Est. Exper. Aula Dei, 5 (1-4): 1-266
Butcher, J.W., Snider, R. y Snider, R.J. 1971. Bioecology of edaphic Collembola and Acarina. Ann. Rev. Ent., 16: 249-288.
Cancela Da Fonseca, J.P. y Poinsot, N. 1983. Les regimes alimentaires des microarthropodes du sol en relation avec la decomposition de la matiere organique. Bull. Soc. Zool. France, 108(3): 371-388.
Cassagnau, P., 1986 a. Les écomorphoses des collemboles. I. Déviation de la morphogènese et perturbations histophysiologiques. Annls. Soc. Ent. Fr., 22: 7-33.
Cassagnau, P. 1986 b. Les écomorphoses des collemboles. II. Aspects phénologiques et analyse expérimentale des déterminismes. Annls. Soc. Ent. Fr., 22: 7-33.
Chagnon, M., Hébert, C. y Paré, D. 2000. Community structures of Collembola in sugar maple forests: relations to humus type and seasonal trends. Pedobiologia, 44: 148-174.
Czarnecki, A. 1983. Springtails as index of forest site development. New trends in soil biology. Ph. Lebrun et al. (eds): 643-645.
Deharveng, L. 1996. Soil Collembola Diversity, Endemism, and Reforestation: A Case Study in the Pyrenees (France). Conservation Biology, 10(1): 74-84.
Gama, M.M., Sousa, J.P., Ferreira, C. y Barrocas, H. 1997. Endemic and rare Collembola distribution in High Endemism Areas of South Portugal: A case study. Eur. J. Soil Biol., 33(3): 129-140.
Gisin, H. 1943. Okologie und Lebensgemeinschaften der Collembolen im Schweizerischen Exkursionsgebiet Basels. Rev. Suisse Zool., 50: 131-224.
Greenslade, P. 1981. Survival of Collembola in arid environments: observations in South Australia and the Sudan. Journal of arid environments, 4: 219-228.
Jordana, R. y Arbea, J. I. 1992. Xenyllogastrura steineri n. sp. y su comparación con las especies, del mismo género, presentes en la Península Ibérica e Islas Canarias (Collembola, Hypogastruridae), Boln. Asoc. Esp. Ent., 16: 11-17.
Jordana, R., Arbea, J. I., Simón, C. y Luciañez, M. J. 1997. Collembola, Poduromorpha. En: Fauna Ibérica, vol. 8. RAMOS, M.A. et al. (Eds.). Museo Nacional de Ciencias Naturales. CSIC. Madrid. 807 pp.
Lawrence, P. N. 2000. From Whence and Whither the Crustacea. Evolution versus Taxonomy, Part 1. Disponible desde Internet en: http://www.collembola.co.uk
Mateos, E. y Selga, D. 1991. Efecto de los incendios forestales sobre las poblaciones de colémbolos edáficos en bosque mediterráneo. Rev. Écol. Biol. Sol, 28(1): 19-30.
Navás, L. 1906. Neurópteros de España y Portugal. Broteria Caminha, 5: 159-167.
Nayrolles, P. 1990. Description d’une nouvelle espèce de Spatulosmin-thurus (Collemboles Symphypléones). Bull. Soc. Hist. Nat., Toulouse, 126: 65-71.
Nayrolles, P. 1995a. Taxonomy of European species of Cassagnaudiella and Bourletiella (Collembola, Symphypleona, Bourletiellidae). Zoologica Scripta, 24(1): 43-60.
Nayrolles, P. 1995b. A standardized description of European Sminthuridae (Collembola, Symphypleona), 3: description of seven species of Sminthurus, including four new to science. Bijdragen tot de Dierkunde, 64(4): 215-237.
Ochoa, M. J., 1982. Relaciones entre el medio y comunidades vegetales del sabinar continental árido en el Valle del Ebro. INIA, Madrid, 52 pp.
Petersen, H. y Luxton, M. 1982. A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos, 39(3): 288-388.
Pitarque, J. 1906. Colémbolos de Zaragoza. Boletín de la Sociedad Aragonesa de Ciencias Naturales, 5: 97-100.
Poinsot, N. 1966a. Existence d'un comportement constructeur chez un collembole Isotomidae: Subisotoma variabilis (Gisin, 1949). Rev. Ecol. Biol. Sol, 3: 173-178.
Poinsot, N. 1966b. Sur un comportement constructeur chez le collembole Isotomurus sp. Relation entre ce comportement et le phénomene de l'écomorphose. Rev. Ecol. Biol. Sol, 3: 585-588.
Poinsot, N. 1968. Cas d'anhydrobiose chez le collembole Subisotoma variabilis Gisin. Rev. Ecol. Biol. Sol, 5: 585-586.
Poinsot, N. 1976. Dynamique des communautés de Collemboles en milieu xerique mediteranéen. Pedobiologia, 16: 1-17.
Poinsot-Balaguer, N. 1984. Comportement des microarthropodes du sol en climat mediterranéen française. Bull. Soc. bot. Fr., 131, Actual. bot., (2/3/4): 307-318.
Poinsot-Balaguer, N. y Barra, J. A. 1978. Adaptation de certains collemboles a la secheresse: L'anhidrobiose. Bull. Soc. Ecophysiol., 3(1): 56-58.
Poinsot-Balaguer, N. y Barra, J. A., 1991. L'anhydrobiose: un problème biologique nouveau chez les Collemboles (Insecta). Rev. Écol. Biol. Sol, 28(2): 197-205.
Ponge, J. F. 1980. Les biocénoses des collemboles de la forêt de Sénart. In: Actualités d'Ecologie Forestière. Ed. Pesson, Gauthier-Villars. Paris, 517 pp.
Ponge, J. F. 1983. Les collemboles, indicateurs du type d´humus en milieu forestier. Résultats obtenus au Sud de Paris. Acta Oecologica. Oecologia Generale, 4: 359-374.
Ponge, J. F. 1985. Utilisation de la micromorphologie pour l'étude des relations trophiques dans le sol: la couche L d'un moder hydromorphe sous Pinus sylvestris (Forêt d'Orléans, France). Bull. Ecol., 16(1): 117-132.
Ponge, J. F. 1998. Etude écologique d'un humus forestier par l'observation d'un petit volume. III. La couche F1 d'un moder sous Pinus sylvestris. Pedobiologia, 31: 1-64.
Quirantes, J. 1978. Estudio sedimentológico y estratigráfico del Terciario Continental de los Monegros. CSIC, Zaragoza, 200 pp.
Rivas-Martínez, S. 1987. Memoria del mapa de series de vegetación de España, ICONA, Madrid, 268 pp.
Vannier, G. 1973. Incidence du climat sur les microarthropodes d'un sol forestier en region temperée. II. Relations faune-climat. Bull. Ecol., 4(3): 151-185.
Vannier, G. 1980. Role de la faune du sol associée a la microflore dans la degradation de la matiere organique. UER, Univ. Nancy I, 3(2): 24-70.
Wilkening, A. J., Foltz, J. L., Atkinson, T. H. y Connor, M. D. 1981. An omnidirectional flight trap for ascending and descending insects. Can. Ent., 113: 453-455.